
| A. | 元素Z、W分别与Y形成的常见化合物均为碱性氧化物 | |
| B. | X和R形成的常见化合物中各原子都达到8电子稳定结构 | |
| C. | 离子半径的大小顺序为:Z+>W2+>Y2- | |
| D. | 含有Y、Z、R三种元素的化合物最多只有3种 |
分析 X、Y、Z、W、R是短周期元素,X原子的电子总数等于其电子层数的3倍,则X为C元素;Y元素在地壳中的含量很多,Z+、W2+、与Y2-具有相同的电子层结构,则Z为Na、W为Mg,Y为O.R原子的核外电子数是X原子与Z原子的核外电子数之和,则R原子核外电子数为6+11=17,故R为Cl,据此解答.
解答 解:X、Y、Z、W、R是短周期元素,X原子的电子总数等于其电子层数的3倍,则X为C元素;Y元素在地壳中的含量很多,Z+、W2+、与Y2-具有相同的电子层结构,则Z为Na、W为Mg,Y为O.R原子的核外电子数是X原子与Z原子的核外电子数之和,则R原子核外电子数为6+11=17,故R为Cl.
A.元素Na、Mg分别与O形成的常见化合物有氧化钠、过氧化钠、氧化镁,氧化钠、氧化镁属于碱性氧化物,过氧化钠与水反应生成氢氧化钠与氧气,不属于碱性氧化物,故A错误;
B.C和Cl形成的常见化合物为CCl4,分子中各原子都达到8电子稳定结构,故B正确;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Mg2+,故C错误;
D.Na、O、Cl三种元素可以形成化合物NaClO、NaClO2、NaClO3、NaClO4,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
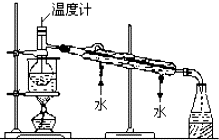 海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:
海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 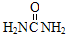 | B. | H2NCH2CH2NH2 | C. | (NH4)2CO3 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2中既含离子键又含非极性键 | |
| B. | BF3分子中的所有原子共平面 | |
| C. | SiO2和Na2O2的晶体类型相同 | |
| D. | S的第一电离能大于P的第一电离能. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,分子式:C3H4N2,与苯有类似结构和性质.有关它的说法错误的是( )
,分子式:C3H4N2,与苯有类似结构和性质.有关它的说法错误的是( )| A. | 是芳香族化合物 | |
| B. | 能发生加成、取代、氧化反应 | |
| C. | 每个分子中有9个σ键 | |
| D. | 分子极性键又含有非极性键中既含有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定含有Fe3+离子,不含Fe2+ | |
| B. | 原溶液中一定含有Fe2+离子,不含Fe3+ | |
| C. | 溶液中的Fe2+离子被氯气还原为Fe3+ | |
| D. | 溶液中同时含Fe2+或Fe3+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的前四周期五种元素X、Y、Z、M、W.已知X的一种单质是原子晶体,且是自然界中最坚硬的物质,Y原子最外层电子数是次外层的3倍,M与Y同主族,且M元素的单质为淡黄色;Z与M同周期,且Z元素与Y元素可以形成两种化合物,其中一种化合物也为淡黄色;W是生活中使用最广泛的金属元素,且有+2和+3两种常见化合价.据此回答:
原子序数依次增大的前四周期五种元素X、Y、Z、M、W.已知X的一种单质是原子晶体,且是自然界中最坚硬的物质,Y原子最外层电子数是次外层的3倍,M与Y同主族,且M元素的单质为淡黄色;Z与M同周期,且Z元素与Y元素可以形成两种化合物,其中一种化合物也为淡黄色;W是生活中使用最广泛的金属元素,且有+2和+3两种常见化合价.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 稀硫酸滴入碳酸钠溶液中,将产生的气体通入盛有硅酸钠溶液的烧杯中 | 烧杯中产生白色胶状沉淀 | 非金属性:S>C>Si |
| B | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 将饱和氯化铁溶液滴入盛有沸水的烧杯中,继续煮沸至溶液呈红褐色,停止加热,用激光笔照射烧杯中的液体 | 看到一条光亮的“通路” | 证明生成了氢氧化铁沉淀 |
| D | 在分液漏斗中加入碘水后再加入CCl4,充分振荡、静置 | 分层,且上层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com