
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

①第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________________。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g) ΔH=-226kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为________________。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=______________。
【答案】放热 ΔH<0(或反应物的总能量大于生成物的总能量) NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1 2NA(或1.204×1024) 369
【解析】
本题主要考查热化学方程式的分析与计算。
(1)ΔH<0,则反应为放热反应,根据盖斯定律第一步+第二步即为总的热化学方程式。
(2)根据盖斯定律可知①+2×②即为所求热化学方程式,再根据得失电子计算电子转移数目。
(3)化学反应的焓变等于反应物的总键能-生成物的总键能。
(1)由图可知ΔH<0,则反应为放热反应,根据盖斯定律可知![]() ①
①
![]() ②;根据盖斯定律可知:①+②可得:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;
②;根据盖斯定律可知:①+②可得:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;
故答案为:放热;ΔH<0(或反应物的总能量大于生成物的总能量);NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;
(2)2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①;Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g) ΔH=-226kJ·mol-1②;根据盖斯定律可知:①+2×②得:![]() ,当反应放出509kJ热量时有1molCO参与反应,电子转移数目为2NA(或1.204×1024);
,当反应放出509kJ热量时有1molCO参与反应,电子转移数目为2NA(或1.204×1024);
故答案为:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;2NA(或1.204×1024);
(3)H2(g)+Br2(l)=2HBr(g)ΔH=-72kJ·mol-1①蒸发1molBr2(l)需要吸收的能量为30kJ,Br2(l)= Br2(g) ΔH=30kJ·mol-1②,①-②得H2(g)+Br2(g)=2HBr(g) ΔH=-102kJ·mol-1,化学反应的焓变等于反应物的总键能-生成物的总键能,由表可知200+436-2a=-102,解得a=369;
故答案为:369。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)![]() 2CO2(g) ΔH=566 kJ·mol1;
2CO2(g) ΔH=566 kJ·mol1;
Na2O2(s)+CO2(g)![]() Na2CO3(s)+
Na2CO3(s)+![]() O2(g) ΔH=226 kJ·mol1
O2(g) ΔH=226 kJ·mol1

根据以上热化学方程式和图像判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>452 kJ·mol1
C. 上图可表示由1 mol CO生成CO2的反应过程和能量关系
D. 根据以上热化学方程式无法求算Na2O2(s)+CO(g)===Na2CO3(s)的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
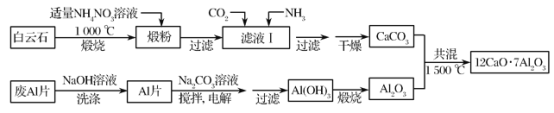
(1)煅粉主要含MgO和________,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,若溶液Ⅰ中c(Mg2+)小于5×10-6mol·L-1,则滤液pH大于________[Mg(OH)2的Ksp=5×10-12];该工艺中不能用(NH4)2SO4代替NH4NO3,原因是______________。
(2)滤液Ⅰ中的阴离子有________(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为_________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式________。
(5)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
(1)ClO2的制备及性质探究(如图所示)。

①仪器a的名称为________,装置B的作用是________。
②装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为_________。装置D中滴有几滴淀粉溶液,其作用是________________。
③装置E用于吸收尾气,反应生成NaClO2,则该反应中氧化剂与还原剂的物质的量之比为________,氧化产物是___________。
(2)粗略测定生成ClO2的量
实验步骤如下:
a. 取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤D瓶2~3次,并将洗涤液一并转移到容量瓶中,再用蒸馏水稀释至刻度。
b. 从容量瓶中取出25.00mL溶液于锥形瓶中,用0.1000mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去24.00 mL硫代硫酸钠溶液。
①滴定至终点的现象是_____________。
②进入装置D中的ClO2质量为_______,与C中ClO2的理论产量相比,测定值偏低,可能的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下将1.92g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12 L,则反应消耗HNO3的物质的量为
A. 0.08molB. 0.06molC. 0.11molD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是

A. 冰表面第一层中,HCl以分子形式存在
B. 冰表面第二层中,H+浓度为5×103 mol·L1(设冰的密度为0.9 g·cm3)
C. 冰表面第三层中,冰的氢键网格结构保持不变
D. 冰表面各层之间,均存在可逆反应HCl![]() H++Cl
H++Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如下图。下列说法正确的是

A. 曲线I和曲线II分别代表的是CH3COOH和HCN
B. 点①和点②所示溶液中: ![]()
C. 点③和点⑤所示溶液中由水电离出的c(H+):⑤>③
D. 在点②和③之间(不包括端点)存在关系:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)和碲(Te)有许多优良性能,被广泛用于冶金、化工、医药卫生等领域。工业上以铜阳极泥(含有Cu、Cu2S、Cu2Se、Cu2Te等)为原料制备硒和碲的一种生产工艺如下图所示:
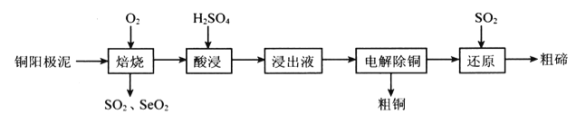
已知:“酸浸”过程中TeO2与硫酸反应生成TeOSO4。
(1)焙烧时通入氧气使铜阳极泥沸腾,目的是________________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,该反应中氧化产物与还原产物的物质的量之比为_____________。已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.6×10-7,NaHSeO3溶液的pH________7(填“>”、“<”或“=”),理由是____________________。
(3)“浸出液”的溶质成分除了TeOSO4外,还有_______________。上述整个流程中可以循环使用的物质是___________________。
(4)“还原”步骤中生成Te的化学方程式为_______________________;Te也可以通过碱性环境下电解Na2TeO3溶液获得,其阴极的电极反应式为___________________。
(5)粗硒中硒的含量可用如下方法测定:
①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;
②SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
③I2+2Na2S2O3=Na2S4O6+2NaI
通过用Na2S2O3标准溶液滴定反应②中生成的I2来计算硒的含量。实验中准确称量0.1200 g粗硒样品,滴定中消耗0.2000 mol·L-1Na2S2O3溶液24.00 mL,则粗硒样品中硒的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
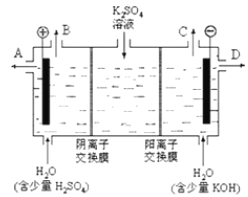
(1)该电解槽的阳极反应为________________________,此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2) 制得的氢氧化钾溶液从出口________(填写“A”、“B”、“C”、“D”)导出,制得的氧气从出口________ (填写“A”、“B”、“C”、“D”)导出。
(3)通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________ 。
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com