
����Ŀ����(Se)����(Te)�������������ܣ����㷺����ұ�𡢻�����ҽҩ����������ҵ����ͭ������(����Cu��Cu2S��Cu2Se��Cu2Te��)Ϊԭ���Ʊ������ڵ�һ��������������ͼ��ʾ��
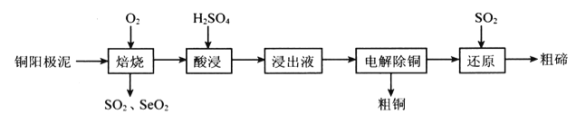
��֪���������������TeO2�����ᷴӦ����TeOSO4��
(1)����ʱͨ������ʹͭ��������ڣ�Ŀ����________________��
(2)SeO2��SO2�Ļ����������ˮ�����Ƶõ���Se���÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ_____________����֪25��ʱ��������(H2SeO3)��Ka1=2.5��10-3��Ka2=2.6��10-7��NaHSeO3��Һ��pH________7(�>������<����=��)��������____________________��
(3)������Һ�������ʳɷֳ���TeOSO4�⣬����_______________���������������п���ѭ��ʹ�õ�������___________________��
(4)����ԭ������������Te�Ļ�ѧ����ʽΪ_______________________��TeҲ����ͨ�����Ի����µ��Na2TeO3��Һ��ã��������ĵ缫��ӦʽΪ___________________��
(5)���������ĺ����������·����ⶨ��
��Se+2H2SO4(Ũ)=2SO2��+SeO2+2H2O��
��SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O��
��I2+2Na2S2O3=Na2S4O6+2NaI
ͨ����Na2S2O3����Һ�ζ���Ӧ�������ɵ�I2���������ĺ�����ʵ����ȷ����0��1200 g������Ʒ���ζ�������0.2000 mol��L-1Na2S2O3��Һ24��00 mL���������Ʒ��������������Ϊ_______________��
���𰸡� ����������ͭ������ĽӴ�������ӿ췴Ӧ���� 2:1 < HSeO3-��ˮ�ⳣ��![]() ������Ka1<Ka2����NaHSeO3��Һ��pH<7 CuSO4 H2SO4 2SO2+TeOSO4+3H2O=Te+3H2SO4 TeO32-+3H2O+4e-=Te+6OH- 79%
������Ka1<Ka2����NaHSeO3��Һ��pH<7 CuSO4 H2SO4 2SO2+TeOSO4+3H2O=Te+3H2SO4 TeO32-+3H2O+4e-=Te+6OH- 79%
�����������������(1)���������ʱ�������Ӵ�����Ӵ���
(2)SeO2��SO2�Ļ����������ˮ�����Ƶõ���Se��Se���ϼ۽��ͣ�����SO2����Ԫ�������������ᣬ���ݵ����غ��ж����������뻹ԭ��������ʵ���֮�ȡ�����HSeO3-��ˮ�ⳣ���͵���ƽ�ⳣ����С�Ƚ��ж�NaHSeO3��Һ��pH��
(3)����Ԫ���غ����������Һ�������ʳɷ֡�
(4) ����ԭ��������SO2��TeOSO4����Te��Na2TeO3����Te������ԭ��Ӧ������TeO32-�õ�������Te��
(5)����������ԭ��Ӧ��ϵʽ������������������
������(1) ���������ʱ�������Ӵ�����Ӵ�Ŀ���Ǽӿ췴Ӧ���ʡ�
(2)SeO2��SO2�Ļ����������ˮ�����Ƶõ���Se������ʽΪSeO2+2SO2+2H2O=Se+2H2SO4������������H2SO4����ԭ������Se�����������뻹ԭ��������ʵ���֮��Ϊ2:1��HSeO3-��ˮ�ⳣ��![]() ��HSeO3-�ĵ���ƽ�ⳣ��2.6��10-7���������ˮ�⣬����NaHSeO3��Һ��pH<7��
��HSeO3-�ĵ���ƽ�ⳣ��2.6��10-7���������ˮ�⣬����NaHSeO3��Һ��pH<7��
(3) ����Ԫ���غ㡰����Һ�������ʳɷֳ���TeOSO4�⣬����CuSO4�����������п���ѭ��ʹ�õ�������H2SO4��
(4) ����ԭ��������SO2��TeOSO4����Te�ķ���ʽΪ2SO2+TeOSO4+3H2O=Te+3H2SO4��Na2TeO3����Te������ԭ��Ӧ������TeO32-�õ�������Te��������ӦʽΪTeO32-+3H2O+4e-=Te+6OH- ��
(5)��Se������Ϊxg�����ݹ�ϵʽ

![]()
X=0.0948g
�������Ʒ��������������Ϊ![]() 79% ��
79% ��


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��ȷ����
A. �����ȼ������H����890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4(g)��2O2(g)=CO2(g)��2H2O(g) ��H����890.3kJ��mol��1
B. 500�桢30MPa�£���0.5molN2(g)��1.5mol H2(g)�����ܱ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪN2(g)��3H2(g)![]() 2NH3(g) ��H����38.6kJ��mol��1
2NH3(g) ��H����38.6kJ��mol��1
C. HCl��NaOH��Ӧ���к�����H��-57.3kJ��mol��1����H2SO4��Ca(OH)2��Ӧ���к�����H��2��(-57.3)kJ��mol��1
D. ��֪2C(s)��2O2(g)=2CO2(g) ��H��a��2C(s)��O2(g)=2CO(g) ��H��b����a<b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)���������õ������£�NH4+����������Ӧ��������NO3-��������Ӧ�������仯ʾ��ͼ���£�

�ٵ�һ����Ӧ��________(��������������������)��Ӧ���ж�������________________��
��1molNH4+(aq)ȫ��������NO3-(aq)���Ȼ�ѧ����ʽ��___________________________��
(2)��֪��2CO(g)+O2(g)=2CO2(g)����H=-566kJ��mol-1��
Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g)����H=-226kJ��mol-1��
��CO(g)��Na2O2(s)��Ӧ�ų�509kJ����ʱ������ת����ĿΪ________________��
(3)��֪H2(g)+Br2(l)=2HBr(g)����H=-72kJ��mol-1������1molBr2(l)��Ҫ���յ�����Ϊ30kJ����������������±���
���� | H2(g) | Br2(g) | HBr(g) |
1mol�����еĻ�ѧ������ʱ��Ҫ���յ�����(kJ) | 436 | 200 | a |
�����a=______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п�C����ȼ�ϵ�ؿ������綯��������Դ����صĵ������ҺΪKOH��Һ����ӦΪ2Zn+O2+4OH��+2H2O![]() 2Zn(OH)42��������˵����ȷ����
2Zn(OH)42��������˵����ȷ����
A.���ʱ����·��ÿͨ��1mol���ӣ��������Һ�о���0.5mol K+�������ƶ�
B.���ʱ���������Һ��c(OH��) ��С
C.�ŵ�ʱ��������ӦΪ��Zn��4OH����2e�C��Zn(OH)42��
D.�ŵ�ʱ����·��ͨ��2mol���ӣ���������22.4L(��״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t ��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t ��ʱAgCl��Ksp��4��10��10 mol2��L��2������˵������ȷ����

A.��t ��ʱ��AgBr��KspΪ4.9��10��13 mol2��L��2
B.��AgBr������Һ�м���NaBr���壬��ʹ��Һ��b�㵽c��
C.ͼ��a���Ӧ����AgBr�IJ�������Һ
D.��t ��ʱ��AgCl(s)��Br��(aq)![]() AgBr(s)��Cl��(aq)��ƽ�ⳣ��K��816
AgBr(s)��Cl��(aq)��ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���![]()
![]()
��1���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��![]()
�¶� | 250�� | 300�� | 350�� |
K |
|
|
|
�ٸ÷�Ӧ��ƽ�ⳣ������ʽ![]() ______________��
______________��![]() __________
__________![]() ����
����![]() ������
������![]() ������
������![]() ��
��![]() ��
��
��ij�¶��£���![]() ��
��![]() ����2L���ܱ������У���ַ�Ӧ10min�ﵽƽ��ʱ���
����2L���ܱ������У���ַ�Ӧ10min�ﵽƽ��ʱ���![]() ����CO��ת����Ϊ____________����ʱ���¶�Ϊ_________��
����CO��ת����Ϊ____________����ʱ���¶�Ϊ_________��
��2����![]() ��
��![]() ��Һ�м���
��Һ�м���![]() �����ᣬ���ɳ�������֪���¶���AgCl��
�����ᣬ���ɳ�������֪���¶���AgCl��![]() ��������Һ������仯������㣺
��������Һ������仯������㣺
����ȫ��������Һ��![]() ________��
________��
����ȫ��������Һ��![]() ________��
________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ����̽��NaHCO3�����ʣ������£�����0.10 mol/ L NaHCO3��Һ������pHΪ8.4��ȡ��������Һ�μ�CaCl2��Һ��pH=7���μӹ����в�����ɫ��������������ų�������˵������ȷ����( )
A. NaHCO3��Һ�ʼ��Ե�ԭ����HCO3-��ˮ��̶ȴ��ڵ���̶�
B. ��Ӧ�Ĺ����в����İ�ɫ����ΪCaCO3
C. ��Ӧ�����Һ�д��ڣ�c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
D. ����CaCl2�ٽ���HCO3-��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������ܶȻ�������Ksp[Pb��OH��2]=2��10-15��Ksp[Fe��OH��2]=8��10-15������Һ�н�������Ũ��С��10-5molL-1��Ϊ������ȫ����20mL��0.10molL-1Pb2+��0.10molL-1Fe2+�Ļ����Һ�еμ�0.10molL-1NaOH��Һ������������Ũ�������NaOH��Һ����Ĺ�ϵ������ͼ��ʾ��������˵����ȷ���ǣ� ��

A.����A��ʾc(Pb2+)������
B.����ҺpH=8ʱ��Fe2+��ʼ������Pb2+������ȫ
C.����NaOH��Һ�������30mLʱ����Һ��c(Fe2+)=4c(Pb2+)
D.�����£��μ�NaOH��Һ�����У� ��ֵ��������
��ֵ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������ȼ�ϵ�أ�������Ϊ�缫����KOH��Һ�У��ֱ�������ͨ������������缫��ӦΪ��C2H6+18OH--14e-=2CO32-+12H2O��7H2O+![]() O2+14e-=14OH-
O2+14e-=14OH-
�йش˵�ص��ƶϴ�����ǣ� ��
A.ͨ����ĵ缫Ϊ����
B.�μӷ�Ӧ��O2��C2H6�����ʵ���֮��Ϊ7��2
C.�ŵ�һ��ʱ���KOH�����ʵ���Ũ�Ƚ��½�
D.�ڵ������Һ��CO32-�������ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com