
【题目】锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O![]() 2Zn(OH)42-。下列说法正确的是
2Zn(OH)42-。下列说法正确的是
A.充电时,电路中每通过1mol电子,电解质溶液中就有0.5mol K+向阳极移动
B.充电时,电解质溶液中c(OH-) 逐渐减小
C.放电时,负极反应为:Zn+4OH--2e–=Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A.SO2易溶于水只是因为相似相溶原理
B.乳酸(![]() )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C.H3PO4分子中P原子采取sp3杂化
D.由图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
(1)ClO2的制备及性质探究(如图所示)。

①仪器a的名称为________,装置B的作用是________。
②装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为_________。装置D中滴有几滴淀粉溶液,其作用是________________。
③装置E用于吸收尾气,反应生成NaClO2,则该反应中氧化剂与还原剂的物质的量之比为________,氧化产物是___________。
(2)粗略测定生成ClO2的量
实验步骤如下:
a. 取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤D瓶2~3次,并将洗涤液一并转移到容量瓶中,再用蒸馏水稀释至刻度。
b. 从容量瓶中取出25.00mL溶液于锥形瓶中,用0.1000mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去24.00 mL硫代硫酸钠溶液。
①滴定至终点的现象是_____________。
②进入装置D中的ClO2质量为_______,与C中ClO2的理论产量相比,测定值偏低,可能的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是

A. 冰表面第一层中,HCl以分子形式存在
B. 冰表面第二层中,H+浓度为5×103 mol·L1(设冰的密度为0.9 g·cm3)
C. 冰表面第三层中,冰的氢键网格结构保持不变
D. 冰表面各层之间,均存在可逆反应HCl![]() H++Cl
H++Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如下图。下列说法正确的是

A. 曲线I和曲线II分别代表的是CH3COOH和HCN
B. 点①和点②所示溶液中: ![]()
C. 点③和点⑤所示溶液中由水电离出的c(H+):⑤>③
D. 在点②和③之间(不包括端点)存在关系:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国国标推荐的食品药品中Ca元素含量的测定方法之一为:利用Na2C2O4将处理后的样品中的Ca2+沉淀,过滤洗涤,然后将所得CaC2O4固体溶于过量的强酸,最后使用已知浓度的KMnO4溶液通过滴定来测定溶液中Ca2+的含量。针对该实验中的滴定过程,回答以下问题:
(1)KMnO4溶液应该用________(填“酸式”或“碱式”)滴定管盛装,除滴定管外,还需要的玻璃仪器有________________________________________________________________
(2)试写出滴定过程中发生反应的离子方程式:__________________________________
(3)如何判断滴定终点 ________________________________________________________。
(4)以下操作会导致测定的结果偏高的是________(填字母)。
a.装入KMnO4溶液前未润洗滴定管 b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液 d.滴定过程中,振荡时将待测液洒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)和碲(Te)有许多优良性能,被广泛用于冶金、化工、医药卫生等领域。工业上以铜阳极泥(含有Cu、Cu2S、Cu2Se、Cu2Te等)为原料制备硒和碲的一种生产工艺如下图所示:
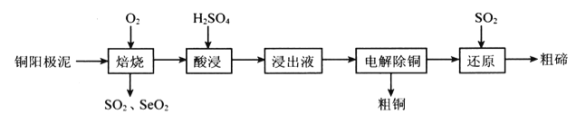
已知:“酸浸”过程中TeO2与硫酸反应生成TeOSO4。
(1)焙烧时通入氧气使铜阳极泥沸腾,目的是________________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,该反应中氧化产物与还原产物的物质的量之比为_____________。已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.6×10-7,NaHSeO3溶液的pH________7(填“>”、“<”或“=”),理由是____________________。
(3)“浸出液”的溶质成分除了TeOSO4外,还有_______________。上述整个流程中可以循环使用的物质是___________________。
(4)“还原”步骤中生成Te的化学方程式为_______________________;Te也可以通过碱性环境下电解Na2TeO3溶液获得,其阴极的电极反应式为___________________。
(5)粗硒中硒的含量可用如下方法测定:
①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;
②SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
③I2+2Na2S2O3=Na2S4O6+2NaI
通过用Na2S2O3标准溶液滴定反应②中生成的I2来计算硒的含量。实验中准确称量0.1200 g粗硒样品,滴定中消耗0.2000 mol·L-1Na2S2O3溶液24.00 mL,则粗硒样品中硒的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度(T℃)的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-ymol·L-1,x与y的关系如图所示:
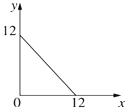
此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为____________。
Ⅱ.常温下,如果取 0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=________ mol·L-1,c(OH-)-c(HA)=________ mol·L-1;
(2)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH____7(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com