
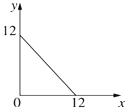
����Ŀ����.ij�¶�(T��)����Һ�У�c(H+)��10-xmol��L-1��c(OH-)��10-ymol��L-1��x��y�Ĺ�ϵ��ͼ��ʾ��
���¶��£�0.01mol/L��NaOH��Һ��ˮ�������OH��Ũ��Ϊ____________��
��.�����£����ȡ 0.1 mol��L��1 HA��Һ��0.1 mol��L��1 NaOH��Һ��������(���Ի�Ϻ���Һ����ı仯)����û����Һ��pH��8���Իش��������⣺
(1)��������Һ��������ʽ�ľ�ȷ������(���������)��c(Na��)��c(A��)��________ mol��L��1��c(OH��)��c(HA)��________ mol��L��1��
(2)��֪NH4A��ҺΪ���ԣ���֪HA��Һ�ӵ�Na2CO3��Һ��������ų������ƶ�(NH4)2CO3��Һ��pH____7(������������������������)��
���𰸡�1��10-10mol��L-1 9.9��10-7 10��8 ��
��������
��. ���ͼ���ȸ���ˮ�����ӻ�������ʽKw=c(H+)��c(OH-)��������¶���ˮ�����ӻ��� 0.01mol/LNaOH��Һ��c(OH-)=0.01mol/L��H��ȫ����ˮ����õ����ٸ���ˮ�����ӻ���������ˮ����������ӵ�Ũ�ȣ�������ˮ��������������ӵ�Ũ����ˮ������������ӵ�Ũ����Ƚ���ȷ��ˮ��������������ӵ�Ũ�ȣ�
��.��1��0.1 mol��L��1 HA��Һ��0.1 mol��L��1 NaOH��Һ�������ϣ�ǡ�÷�Ӧ����NaA��Һ����Һ�д��ڵ���غ�c(Na+)+c(H+)=c(OH-)+c(A-)�������غ�c(Na+)=c(A-)+c(HA)���ݴ˽��м��㣻
��2����������Һ����Ե��жϹ��ɡ�˭ǿ��˭�ԣ�ͬǿ�����ԡ��ж�̼��淋�����ԡ�
��.���¶��£���Һ��ˮ�����ӻ�����Kw=c(H+)��c(OH-)��ˮ�����ӻ�=10-x��10-y=10-(x+y)����ͼ���֪��x+y=12����Kw=1.0��10-12��0.01mol/LNaOH��Һ��c(OH-)=0.01mol/L��H��ȫ����ˮ����õ�������ˮ�����ӻ���������Һ��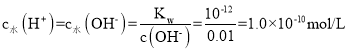 ��
��
�ʴ�Ϊ��1��10-10mol��L-1��
��.��1��0.1 mol��L��1 HA��Һ��0.1 mol��L��1 NaOH��Һ�������ϣ�ǡ�÷�Ӧ����NaA��Һ����Һ�д��ڵ���غ�c(Na+)+c(H+)=c(OH-)+c(A-)���ɵ�c(Na+)-c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9��10-7mol/L����Һ�д��������غ�c(Na+)=c(A-)+c(HA)����������غ����ʽ�ɵ�c(OH-)-c(HA)=c(H+)=1��10-8mol/L��
�ʴ�Ϊ��9.9��10-7��1��10-8��
��2��NH4A��ҺΪ���ԣ���笠�����ˮ��̶ȵ���A-����ˮ��̶ȣ���HA�ĵ���̶Ⱥ�һˮ�ϰ�����̶���ȣ�HA��Һ�ӵ�Na2CO3��Һ��������ų���˵��HA�����Դ���̼�ᣬ��HA�ĵ���̶ȴ���̼�����̶ȣ���һˮ�ϰ��ĵ���̶ȴ���̼��ĵ���̶ȣ�����笠����ӵ�ˮ��̶�С��̼������ӵ�ˮ��̶ȣ�����̼�����Һ�ʼ��ԣ�pH��7��
�ʴ�Ϊ������


 ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ʱ��һ���ܴ����������������
ʱ��һ���ܴ����������������
A.![]() ��
��![]() ��Һ��
��Һ��![]() ��
��![]() ��
��![]() ��
��![]()
B.ͨKSCN��Һ���ɫ����Һ��![]() ��
��![]() ��
��![]() ��
��![]()
C. ����Һ��
����Һ��![]() ��
��![]() ��
��![]() ��
��![]()
D.������Ӧ����������������Һ��![]() ��
��![]() ��
��![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п�C����ȼ�ϵ�ؿ������綯��������Դ����صĵ������ҺΪKOH��Һ����ӦΪ2Zn+O2+4OH��+2H2O![]() 2Zn(OH)42��������˵����ȷ����
2Zn(OH)42��������˵����ȷ����
A.���ʱ����·��ÿͨ��1mol���ӣ��������Һ�о���0.5mol K+�������ƶ�
B.���ʱ���������Һ��c(OH��) ��С
C.�ŵ�ʱ��������ӦΪ��Zn��4OH����2e�C��Zn(OH)42��
D.�ŵ�ʱ����·��ͨ��2mol���ӣ���������22.4L(��״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���![]()
![]()
��1���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��![]()
�¶� | 250�� | 300�� | 350�� |
K |
|
|
|
�ٸ÷�Ӧ��ƽ�ⳣ������ʽ![]() ______________��
______________��![]() __________
__________![]() ����
����![]() ������
������![]() ������
������![]() ��
��![]() ��
��
��ij�¶��£���![]() ��
��![]() ����2L���ܱ������У���ַ�Ӧ10min�ﵽƽ��ʱ���
����2L���ܱ������У���ַ�Ӧ10min�ﵽƽ��ʱ���![]() ����CO��ת����Ϊ____________����ʱ���¶�Ϊ_________��
����CO��ת����Ϊ____________����ʱ���¶�Ϊ_________��
��2����![]() ��
��![]() ��Һ�м���
��Һ�м���![]() �����ᣬ���ɳ�������֪���¶���AgCl��
�����ᣬ���ɳ�������֪���¶���AgCl��![]() ��������Һ������仯������㣺
��������Һ������仯������㣺
����ȫ��������Һ��![]() ________��
________��
����ȫ��������Һ��![]() ________��
________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ����̽��NaHCO3�����ʣ������£�����0.10 mol/ L NaHCO3��Һ������pHΪ8.4��ȡ��������Һ�μ�CaCl2��Һ��pH=7���μӹ����в�����ɫ��������������ų�������˵������ȷ����( )
A. NaHCO3��Һ�ʼ��Ե�ԭ����HCO3-��ˮ��̶ȴ��ڵ���̶�
B. ��Ӧ�Ĺ����в����İ�ɫ����ΪCaCO3
C. ��Ӧ�����Һ�д��ڣ�c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
D. ����CaCl2�ٽ���HCO3-��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������з�����Ӧ��2A(g)��2B(g) ![]() C(s)��3D(g)����H<0���ﵽƽ��ʱ��ȡ���д�ʩ������ʹ����Ӧ���ʦ�������D�����ʵ���Ũ��c(D)�������(����)
C(s)��3D(g)����H<0���ﵽƽ��ʱ��ȡ���д�ʩ������ʹ����Ӧ���ʦ�������D�����ʵ���Ũ��c(D)�������(����)
A. ��С�ݻ�������ѹǿB. �����ݻ�����Сѹǿ
C. ��������CD. �ݻ����䣬���롰���ԡ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������ܶȻ�������Ksp[Pb��OH��2]=2��10-15��Ksp[Fe��OH��2]=8��10-15������Һ�н�������Ũ��С��10-5molL-1��Ϊ������ȫ����20mL��0.10molL-1Pb2+��0.10molL-1Fe2+�Ļ����Һ�еμ�0.10molL-1NaOH��Һ������������Ũ�������NaOH��Һ����Ĺ�ϵ������ͼ��ʾ��������˵����ȷ���ǣ� ��

A.����A��ʾc(Pb2+)������
B.����ҺpH=8ʱ��Fe2+��ʼ������Pb2+������ȫ
C.����NaOH��Һ�������30mLʱ����Һ��c(Fe2+)=4c(Pb2+)
D.�����£��μ�NaOH��Һ�����У� ��ֵ��������
��ֵ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������![]() ��������̼������ɱ�ĺ�ѹ�ܱ������з�Ӧ��
��������̼������ɱ�ĺ�ѹ�ܱ������з�Ӧ��![]() ��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ����
��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ����

A.![]() ʱ��������������壬
ʱ��������������壬![]() ��
��![]() ������С��ƽ�ⲻ�ƶ�
������С��ƽ�ⲻ�ƶ�
B.![]() ʱ����Ӧ��ƽ���
ʱ����Ӧ��ƽ���![]() ��ת����Ϊ
��ת����Ϊ![]()
C.![]() ʱ��������������
ʱ��������������![]() ��CO��ƽ�����淴Ӧ�����ƶ�
��CO��ƽ�����淴Ӧ�����ƶ�
D.ƽ�ⳣ���Ĺ�ϵ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������±������KOH����Һ�м��Ȳ���Ӧ����(�� ��)
��![]() ��
��![]() ��(CH3)3C��CHBr2 ��CHCl2��CHBr2 ��
��(CH3)3C��CHBr2 ��CHCl2��CHBr2 ��![]() ��CH3Cl
��CH3Cl
A. �٢ۢ�B. �ڢۢ�C. �ڢ�D. ȫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com