
【题目】下列对分子性质的解释中,不正确的是( )
A.SO2易溶于水只是因为相似相溶原理
B.乳酸(![]() )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C.H3PO4分子中P原子采取sp3杂化
D.由图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数

科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. SO2![]() CaSO3
CaSO3![]() CaSO4
CaSO4
B. Fe![]() Fe2O3
Fe2O3![]() FeCl3
FeCl3
C. HCl(aq)![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
D. Cu2(OH)2CO3![]() CuO
CuO![]() CuCl2(aq)
CuCl2(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2。“气化炉”中主要反应有:
C(s)+ +H2O (g) =CO(g)+H2(g) △H= +131.3 kJmol-1
CO(g)+H2O(g) =CO2(g)+H2(g) △H= — 41.2kJmol-1
(1)气化炉中CO2与C反应转化为CO,该反应的热化学方程式_____________。
(2)用煤炭气合成甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如图所示:
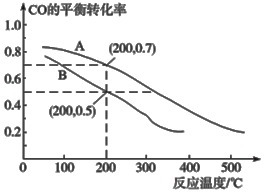
①生成甲醇的反应为_______(填“放热”或“吸热”)。
②图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强是5.0MPa的曲线是____________(填“A”或“B”)。
③在不改变反应物用量的前提下,为提高CO转化率可采取的措施有(写两条措施) _________。
④压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是 _______________。
(3)某新型电池以熔融碳酸盐作电解质,在650℃下工作,负极通入煤炭气,正极通入空气与CO2的混合气.电池的正极反应式为O2+2CO2+4e-=2CO32—,负极反应式为 ___________________和___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠![]() 是常用的食品抗氧化剂之一。某研究小组进行如下实验:
是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取。采用如图装置![]() 实验前已除尽装置内的空气
实验前已除尽装置内的空气![]() 制取
制取![]() 。装置Ⅱ中有
。装置Ⅱ中有![]() 晶体析出,发生的反应为
晶体析出,发生的反应为![]() 。
。

(1)A仪器的名称为: ______ ,实验前要进行 ______ ;装置Ⅰ中产生气体的化学方程式为 ______
(2)浓硫酸 ______ ![]() 能或不能
能或不能![]() 用稀硫酸代替,原因是 ______
用稀硫酸代替,原因是 ______
(3)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 ______
(4)装置Ⅲ用于处理尾气,可选用如图的最合理装置![]() 夹持仪器已略去
夹持仪器已略去![]() 为 ______
为 ______ ![]() 填序号
填序号![]()
a.  b.
b.  c.
c.  d.
d. 
实验二:葡萄酒中抗氧化剂残留量的测定。
(5)葡萄酒常用![]() 作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量
作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量![]() 以游离
以游离![]() 计算
计算![]() 的方案如下:
的方案如下:
葡萄酒样品100.00mL![]() 馏分
馏分![]() 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色![]() 已知:滴定时反应的化学方程式为
已知:滴定时反应的化学方程式为![]()
①按上述方案实验,消耗标准![]() 溶液
溶液![]() ,该次实验测得样品中抗氧化剂的残留量
,该次实验测得样品中抗氧化剂的残留量![]() 以游离
以游离![]() 计算
计算![]() 为 ______
为 ______ ![]()
②在上述实验过程中,若有部分HI被空气氧化,则测定结果 ______ ![]() 填“偏高”“偏低”或“不变”
填“偏高”“偏低”或“不变”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:

有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤___(选填①、②、③、⑤)。
(3)滤渣2的主要成分为___。
(4)写出步骤④后产生滤渣3的离子反应方程式___。
Ⅱ.BaS溶液的制备:

(5)写出煅烧还原的化学反应方程式____。
Ⅲ.制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 某无色溶液中可能含有
某无色溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种,依次进行下列实验。观察到现象如下:
中的若干种,依次进行下列实验。观察到现象如下:
①用pH试纸检验,溶液![]() ;
;
②向溶液中滴加氯水,无气体产生,再加入![]() 振荡、静置,
振荡、静置,![]() 层呈橙红色,用分液漏斗分液;
层呈橙红色,用分液漏斗分液;
③向分液后的水溶液中加入![]() 和
和![]() 混合液,有白色沉淀产生。
混合液,有白色沉淀产生。
④另取原溶液少量加入![]() 和盐酸的混合液,产生白色沉淀。
和盐酸的混合液,产生白色沉淀。
回答下列问题:
(1)溶液中肯定含有的离子是_________;肯定没有的离子是_________。
(2)写出步骤②中的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,一定能大量共存的离子组是
时,一定能大量共存的离子组是
A.![]() 的
的![]() 溶液:
溶液:![]() 、
、![]() 、
、![]() 、
、![]()
B.通KSCN溶液变红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
C.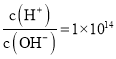 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D.与铝反应产生大量氢气的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O![]() 2Zn(OH)42-。下列说法正确的是
2Zn(OH)42-。下列说法正确的是
A.充电时,电路中每通过1mol电子,电解质溶液中就有0.5mol K+向阳极移动
B.充电时,电解质溶液中c(OH-) 逐渐减小
C.放电时,负极反应为:Zn+4OH--2e–=Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com