
【题目】![]() 某无色溶液中可能含有
某无色溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种,依次进行下列实验。观察到现象如下:
中的若干种,依次进行下列实验。观察到现象如下:
①用pH试纸检验,溶液![]() ;
;
②向溶液中滴加氯水,无气体产生,再加入![]() 振荡、静置,
振荡、静置,![]() 层呈橙红色,用分液漏斗分液;
层呈橙红色,用分液漏斗分液;
③向分液后的水溶液中加入![]() 和
和![]() 混合液,有白色沉淀产生。
混合液,有白色沉淀产生。
④另取原溶液少量加入![]() 和盐酸的混合液,产生白色沉淀。
和盐酸的混合液,产生白色沉淀。
回答下列问题:
(1)溶液中肯定含有的离子是_________;肯定没有的离子是_________。
(2)写出步骤②中的离子方程式_________。
【答案】![]() 、
、![]() 、
、![]()
![]()
![]() 、
、![]()
【解析】
某无色溶液肯定没有![]() 紫色
紫色![]() ,溶液中肯定有
,溶液中肯定有![]() 因为只有它一种阳离子
因为只有它一种阳离子![]() ;
;
①用pH试纸检验,溶液![]() ,说明溶液呈碱性,说明溶液中一定含有
,说明溶液呈碱性,说明溶液中一定含有![]() 。
。
②向溶液中滴加氯水,无气体产生,再加入![]() 振荡、静置,
振荡、静置,![]() 层呈橙红色,说明一定有
层呈橙红色,说明一定有![]() 离子。
离子。
③向分液后的水溶液中加入![]() 和
和![]() 混合液,有白色沉淀产生,该沉淀可能为氯化银,也可能为硫酸银,若沉淀为氯化银,则说明分液后的溶液中含有氯离子,但不能确定氯离子是源自于原溶液中还是加入的氯水所反应的,只能说可能有氯离子。
混合液,有白色沉淀产生,该沉淀可能为氯化银,也可能为硫酸银,若沉淀为氯化银,则说明分液后的溶液中含有氯离子,但不能确定氯离子是源自于原溶液中还是加入的氯水所反应的,只能说可能有氯离子。
④加入硝酸钡和盐酸混合液后,产生白色沉淀,因硝酸具有氧化性,则沉淀可能为BaSO3或BaSO4,无法确定原溶液中是否含有![]() ;
;
(1)根据上述分析可知,原溶液中一定含有的离子是:![]() 、
、![]() 、
、![]() ;一定没有的离子是:
;一定没有的离子是:![]() 。
。
故答案为:![]() 、
、![]() 、
、![]() ;
;![]() 。
。
(2)步骤②中发生反应为氯气与溴离子反应以及氯气与亚硫酸根离子反应,其反应的离子方程式为:![]() 、
、![]() 。
。
故答案为:![]() 、
、![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不发生消去反应的是( )
①![]() ②
②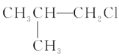 ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A.①③⑥B.②③⑤C.全部D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=—24.8kJ·mol-1
②Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) △H=—15.73kJ·mol-1
CO2(g) △H=—15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
A.-218kJ·mol-1B.-109kJ·mol-1C.+218kJ·mol-1D.+109kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )

A.三种化合物的稳定性顺序:B<A<C
B.两步反应均为放热反应
C.该反应ΔH>0,加入催化剂不改变反应的焓变
D.整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A.SO2易溶于水只是因为相似相溶原理
B.乳酸(![]() )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C.H3PO4分子中P原子采取sp3杂化
D.由图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验 序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)写出草酸与高锰酸钾反应的离子方程式____________。
(2)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=_______、T1=______/span>;通过实验______(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=_____。
(3)忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=____mol·L-1·min-1。
(二)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10 mL 5% H2O2):
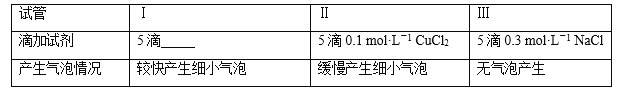
(1)上表试管Ⅰ中应添加的试剂为5滴____________。
(2)结论是_________,实验Ⅲ的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:

回答下列问题:
(1)反应Ⅰ的化学方程式为2C+SiO2 ![]() Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2
Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2 ![]() Si+CO2↑(碳不足)和______(碳足量)。
Si+CO2↑(碳不足)和______(碳足量)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 |
|
|
| HCl |
|
|
质量分数 |
|
|
|
|
|
|
沸点 |
|
|
|
|
|
|
图中“操作X”的名称为______;![]() 的电子式为______。
的电子式为______。
(3)反应Ⅳ的化学方程式为3SiCl4+4NH3 ![]() Si3N4+12HCl,若向2L恒容密闭容器中投入1mol
Si3N4+12HCl,若向2L恒容密闭容器中投入1mol![]() 和1mol
和1mol![]() ,6min后反应完全,则
,6min后反应完全,则![]() min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气
min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气![]() 和
和![]() 在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。
在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 molL-1氨水中加入少量水,pH减小,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国国标推荐的食品药品中Ca元素含量的测定方法之一为:利用Na2C2O4将处理后的样品中的Ca2+沉淀,过滤洗涤,然后将所得CaC2O4固体溶于过量的强酸,最后使用已知浓度的KMnO4溶液通过滴定来测定溶液中Ca2+的含量。针对该实验中的滴定过程,回答以下问题:
(1)KMnO4溶液应该用________(填“酸式”或“碱式”)滴定管盛装,除滴定管外,还需要的玻璃仪器有________________________________________________________________
(2)试写出滴定过程中发生反应的离子方程式:__________________________________
(3)如何判断滴定终点 ________________________________________________________。
(4)以下操作会导致测定的结果偏高的是________(填字母)。
a.装入KMnO4溶液前未润洗滴定管 b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液 d.滴定过程中,振荡时将待测液洒出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com