
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )

A.三种化合物的稳定性顺序:B<A<C
B.两步反应均为放热反应
C.该反应ΔH>0,加入催化剂不改变反应的焓变
D.整个反应的ΔH=E1-E2
科目:高中化学 来源: 题型:
【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是( )

选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | Pb(NO3)2 |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取8.54 g含有Na2CO3、NaOH、Ba(NO3)2的固体混合物溶于足量水中,向反应后的试管中逐滴滴加1.00 mol·L-1的盐酸,加入盐酸的体积和沉淀质量的关系如图所示。

(1)混合物中Ba(NO3)2的物质的量至少为________mol。
(2)X的最大值为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
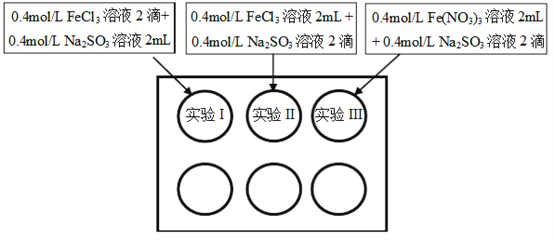
小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠![]() 是常用的食品抗氧化剂之一。某研究小组进行如下实验:
是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取。采用如图装置![]() 实验前已除尽装置内的空气
实验前已除尽装置内的空气![]() 制取
制取![]() 。装置Ⅱ中有
。装置Ⅱ中有![]() 晶体析出,发生的反应为
晶体析出,发生的反应为![]() 。
。

(1)A仪器的名称为: ______ ,实验前要进行 ______ ;装置Ⅰ中产生气体的化学方程式为 ______
(2)浓硫酸 ______ ![]() 能或不能
能或不能![]() 用稀硫酸代替,原因是 ______
用稀硫酸代替,原因是 ______
(3)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 ______
(4)装置Ⅲ用于处理尾气,可选用如图的最合理装置![]() 夹持仪器已略去
夹持仪器已略去![]() 为 ______
为 ______ ![]() 填序号
填序号![]()
a.  b.
b.  c.
c.  d.
d. 
实验二:葡萄酒中抗氧化剂残留量的测定。
(5)葡萄酒常用![]() 作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量
作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量![]() 以游离
以游离![]() 计算
计算![]() 的方案如下:
的方案如下:
葡萄酒样品100.00mL![]() 馏分
馏分![]() 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色![]() 已知:滴定时反应的化学方程式为
已知:滴定时反应的化学方程式为![]()
①按上述方案实验,消耗标准![]() 溶液
溶液![]() ,该次实验测得样品中抗氧化剂的残留量
,该次实验测得样品中抗氧化剂的残留量![]() 以游离
以游离![]() 计算
计算![]() 为 ______
为 ______ ![]()
②在上述实验过程中,若有部分HI被空气氧化,则测定结果 ______ ![]() 填“偏高”“偏低”或“不变”
填“偏高”“偏低”或“不变”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g·cm-3)配制1mol·L-1的稀硫酸100 mL,现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒。按实验时使用仪器的先后顺序,排列正确的是 ( )
A.②⑥③⑦⑤⑥B.②③⑦⑤⑥C.①③⑤⑦④⑥D.④⑦③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 某无色溶液中可能含有
某无色溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种,依次进行下列实验。观察到现象如下:
中的若干种,依次进行下列实验。观察到现象如下:
①用pH试纸检验,溶液![]() ;
;
②向溶液中滴加氯水,无气体产生,再加入![]() 振荡、静置,
振荡、静置,![]() 层呈橙红色,用分液漏斗分液;
层呈橙红色,用分液漏斗分液;
③向分液后的水溶液中加入![]() 和
和![]() 混合液,有白色沉淀产生。
混合液,有白色沉淀产生。
④另取原溶液少量加入![]() 和盐酸的混合液,产生白色沉淀。
和盐酸的混合液,产生白色沉淀。
回答下列问题:
(1)溶液中肯定含有的离子是_________;肯定没有的离子是_________。
(2)写出步骤②中的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中正确的是( )
A. 制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛
B. 炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物
C. 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D. 炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,1L密闭容器中通入H2和I2各0.016 mol,发生如下反应:H2(g)+I2(g)2HI(g),一段时间后达到平衡,测得数据如下:
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.012 | 0.011 | 0.01 | 0.01 |
请回答:(1)2min内,v(H2) =______mol/(L·min)。
(2)下列能证明该反应已经达到平衡的是______(填字母)。
a.V正(H2)=V逆(HI)
b.混合气体的颜色不再发生变化
c.混合气体中各组分的物质的量不再发生变化
d.混合气体的密度不再变化
(3)该温度下反应的化学平衡常数数值是______。
(4)H2的平衡转化率是______。
(5)温度降低时,该反应的平衡常数变大,则正反应是______(填“放热”或“吸热”)反应。
(6)一定可以提高平衡体系中HI百分含量的措施是____(填字母)。
a.降低温度 b.增大H2浓度 c.加入催化剂 d.降低压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com