
【题目】在一定温度下,1L密闭容器中通入H2和I2各0.016 mol,发生如下反应:H2(g)+I2(g)2HI(g),一段时间后达到平衡,测得数据如下:
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.012 | 0.011 | 0.01 | 0.01 |
请回答:(1)2min内,v(H2) =______mol/(L·min)。
(2)下列能证明该反应已经达到平衡的是______(填字母)。
a.V正(H2)=V逆(HI)
b.混合气体的颜色不再发生变化
c.混合气体中各组分的物质的量不再发生变化
d.混合气体的密度不再变化
(3)该温度下反应的化学平衡常数数值是______。
(4)H2的平衡转化率是______。
(5)温度降低时,该反应的平衡常数变大,则正反应是______(填“放热”或“吸热”)反应。
(6)一定可以提高平衡体系中HI百分含量的措施是____(填字母)。
a.降低温度 b.增大H2浓度 c.加入催化剂 d.降低压强
【答案】0.002 bc 1.44 37.5% 放热 a
【解析】
(1)根据![]() 计算v(I2),再利用速率之比等于化学计量数之比计算v(H2)。
计算v(I2),再利用速率之比等于化学计量数之比计算v(H2)。
(2)可逆反应到达平衡时,同种物质表示的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些物理量不变,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡。
(3)7min处于平衡状态,平衡时碘为0.01mol,计算平衡时各组分浓度 代入![]() 计算。
计算。
(4)计算消氢气的物质的量,![]() 。
。
(5)温度降低时,该反应的平衡常数增大,说明平衡向正反应方向移动,降低温度平衡向放热反应移动。
(6)A.降低高温度平衡正向移动,HI的物质的量增大,混合气体总物质的量不变。
B.增大H2浓度平衡正向移动,但HI的含量不一定增大。
C.加入催化剂不影响平衡移动。
D.反应前后气体的体积不变,降低压强平衡不移动。
(1)2min内,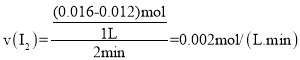 ,速率之比等于化学计量数之比,则
,速率之比等于化学计量数之比,则![]() 。
。
故答案为:0.002。
(2)a.应是2v正(H2)=v逆(HI)时反应处于平衡状态,故a错误。
b.混合气体的颜色不再发生变化,说明碘蒸汽的浓度不变,反应到达平衡,故b正确。
c. 混合气体中各组分的物质的量不再发生变化,说明到达平衡,故c正确。
d. 混合气体总质量不变,容器的容器不变,混合气体的密度始终不变,故d错误。
故选:bc。
(3)7min处于平衡状态,平衡时碘为0.01mol,则:
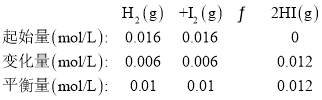
平衡常数 。
。
故答案为:1.44。
(4)消氢气的物质的量为![]() ,则氢气转化率
,则氢气转化率![]() 。
。
故答案为:37.5%。
(5)温度降低时,该反应的平衡常数增大,说明平衡向正反应方向移动,降低温度平衡向放热反应移动。
故答案为:放热。
(6)a.降低高温度平衡正向移动,HI的物质的量增大,混合气体总物质的量不变,HI百分含量增大,故a正确。
b. 增大H2浓度平衡正向移动,如果氢气的剩余量较多,HI的含量不一定增大,故b错误。
c. 加入催化剂加快反应速率,不影响平衡移动,HI百分含量不变,故c错误。
d. 反应前后气体的体积不变,降低压强平衡不移动,HI百分含量不变,故d错误。
故选:a。


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )

A.三种化合物的稳定性顺序:B<A<C
B.两步反应均为放热反应
C.该反应ΔH>0,加入催化剂不改变反应的焓变
D.整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 molL-1氨水中加入少量水,pH减小,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥的二氧化碳和氮气反应可生成氨基甲酸铵固体,化学方程式为:![]()
![]() ,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
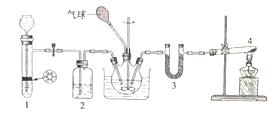
(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为____;装置2中所加试剂为____;
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为________;试管口不能向上倾斜的原因是__________。装置3中试剂为KOH,其作用为______________。
(3)反应时三颈瓶需用冷水浴冷却,其目的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是

A. 冰表面第一层中,HCl以分子形式存在
B. 冰表面第二层中,H+浓度为5×103 mol·L1(设冰的密度为0.9 g·cm3)
C. 冰表面第三层中,冰的氢键网格结构保持不变
D. 冰表面各层之间,均存在可逆反应HCl![]() H++Cl
H++Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中微粒的物质的量浓度关系不正确的是
A.![]() 溶液与
溶液与![]() 溶液等体积混合:
溶液等体积混合:![]()
B.某温度下,![]() ,
,![]() ;将
;将![]()
![]() 的
的![]() 溶液滴入
溶液滴入![]()
![]() 的KCl和
的KCl和![]()
![]() 的
的![]() 溶液,则先产生
溶液,则先产生![]() 沉淀
沉淀
C.![]()
![]() 溶液与
溶液与![]()
![]() 溶液等体积混合:
溶液等体积混合:![]()
D.在![]()
![]() 氨水中滴加
氨水中滴加![]()
![]() 盐酸,刚好完全中和时
盐酸,刚好完全中和时![]() ,则由水电离产生的
,则由水电离产生的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国国标推荐的食品药品中Ca元素含量的测定方法之一为:利用Na2C2O4将处理后的样品中的Ca2+沉淀,过滤洗涤,然后将所得CaC2O4固体溶于过量的强酸,最后使用已知浓度的KMnO4溶液通过滴定来测定溶液中Ca2+的含量。针对该实验中的滴定过程,回答以下问题:
(1)KMnO4溶液应该用________(填“酸式”或“碱式”)滴定管盛装,除滴定管外,还需要的玻璃仪器有________________________________________________________________
(2)试写出滴定过程中发生反应的离子方程式:__________________________________
(3)如何判断滴定终点 ________________________________________________________。
(4)以下操作会导致测定的结果偏高的是________(填字母)。
a.装入KMnO4溶液前未润洗滴定管 b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液 d.滴定过程中,振荡时将待测液洒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝分别和O2、O3发生反应生成Al2O3,反应过程和能量关系如图所示(图中的ΔH表示生成1mol生成物的数据)。下列有关说法中不正确的是( )

A.Al(s)与O3(g)反应生成Al2O3(s)的热化学方程式为2Al(s)+O3(g)=Al2O3(s);ΔH= -1559.5kJ·mol-1
B.等质量的O2比O3的能量低
C.1mol O2完全转化为O3,需吸收142kJ的热量
D.给3O2(g)![]() 2O3(g)的平衡体系加热,有利于O3的生成
2O3(g)的平衡体系加热,有利于O3的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用镁还原硝基苯制取反式偶氮苯。实验原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→![]() +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。

⑴在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁条应用砂纸打磨干净的的原因是___________。
⑵反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤,滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要___________(填“缓慢加入”、“快速加入”)。
②烧杯中的反式偶氮苯转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是___________。
A.冰水 B.饱和NaCl溶液
C.95%乙醇水溶液 D.滤液
③抽滤完毕,应先断开___________之间的橡皮管,以防倒吸。
④重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的___________操作除去了不溶性杂质。
⑶薄层色谱分析中,极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮苯,实验开始时和展开后的斑点如图所示,则反式偶氮苯比顺式偶氮苯的分子极性___________(填“强”或“弱”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com