
【题目】实验室用镁还原硝基苯制取反式偶氮苯。实验原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→![]() +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。

⑴在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁条应用砂纸打磨干净的的原因是___________。
⑵反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤,滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要___________(填“缓慢加入”、“快速加入”)。
②烧杯中的反式偶氮苯转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是___________。
A.冰水 B.饱和NaCl溶液
C.95%乙醇水溶液 D.滤液
③抽滤完毕,应先断开___________之间的橡皮管,以防倒吸。
④重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的___________操作除去了不溶性杂质。
⑶薄层色谱分析中,极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮苯,实验开始时和展开后的斑点如图所示,则反式偶氮苯比顺式偶氮苯的分子极性___________(填“强”或“弱”)。

【答案】除去镁条表面的氧化物 缓慢加入 D 抽气泵和安全瓶 趁热过滤 弱
【解析】
(1)反应加入的镁条应用砂纸打磨干净的原因是除去镁条表面的氧化物;
(2)①结晶速度越慢可得到较大颗粒的晶体,故应缓慢加入乙酸;
②将烧杯中的晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,目的是为了用减少晶体的损失.所以选择冲洗的液体应该是不会使晶体溶解损失,又不会带入杂质的.选择用滤液来物冲洗的液体是最好的,这是因为滤液是饱和溶液,冲洗时不会使晶体溶解,同时又不会带入杂质;故答案为D;
③抽滤完毕,应先断开抽气泵和安全瓶;
④重结晶过程:加热溶解→趁热过滤→冷却结晶→抽滤→洗涤→干燥,其中趁热过滤可以除去不溶性杂质,冷却结晶,抽滤可以除去可溶性杂质;
(3)极性弱的物质,在溶剂中扩散更快,根据图可知展开后顺式偶氮苯较多,扩散较慢,则反式偶氮苯比顺式偶氮苯的分子极性较弱。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,1L密闭容器中通入H2和I2各0.016 mol,发生如下反应:H2(g)+I2(g)2HI(g),一段时间后达到平衡,测得数据如下:
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.012 | 0.011 | 0.01 | 0.01 |
请回答:(1)2min内,v(H2) =______mol/(L·min)。
(2)下列能证明该反应已经达到平衡的是______(填字母)。
a.V正(H2)=V逆(HI)
b.混合气体的颜色不再发生变化
c.混合气体中各组分的物质的量不再发生变化
d.混合气体的密度不再变化
(3)该温度下反应的化学平衡常数数值是______。
(4)H2的平衡转化率是______。
(5)温度降低时,该反应的平衡常数变大,则正反应是______(填“放热”或“吸热”)反应。
(6)一定可以提高平衡体系中HI百分含量的措施是____(填字母)。
a.降低温度 b.增大H2浓度 c.加入催化剂 d.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应:2A(g)+2B(g) ![]() C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率υ正增大、D的物质的量浓度c(D)增大的是( )
C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率υ正增大、D的物质的量浓度c(D)增大的是( )
A. 缩小容积,增大压强B. 扩大容积,减小压强
C. 移走少量CD. 容积不变,充入“惰性”气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 红棕色的NO2加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的![]() 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应:![]() ,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法正确的是
,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法正确的是

A.![]() 时,若充入惰性气体,
时,若充入惰性气体,![]() 、
、![]() 逆均减小,平衡不移动
逆均减小,平衡不移动
B.![]() 时,反应达平衡后
时,反应达平衡后![]() 的转化率为
的转化率为![]()
C.![]() 时,若充入等体积的
时,若充入等体积的![]() 和CO,平衡向逆反应方向移动
和CO,平衡向逆反应方向移动
D.平衡常数的关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
B. NaHSO4在水溶液中的电离方程式:NaHSO4= Na++H++SO42-
C. Na2CO3的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+ H2O![]() H3O++S2-
H3O++S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应式:mX(g)+nY(?)![]() pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的
pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的![]() ,c(X)=0.5mol/L,下列说法正确的是( )
,c(X)=0.5mol/L,下列说法正确的是( )
A.反应向逆方向移动B.Y可能是固体或液体
C.系数n>mD.Z的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
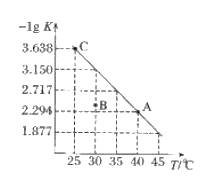
A. 该反应的△H>0
B. C点对应状态的平衡常数K(C)=103.638
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30℃时,B点对应状态的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种中学化学常见的单质及其化合物相互转化的关系图如下:
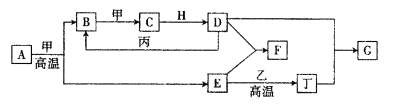
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物
②A由X和Y两种元素组成,其原子个数比为l︰2,元素质量之比为7︰8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为___________,每反应lmol的A转移的电子数为_____________mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式:______________________;
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
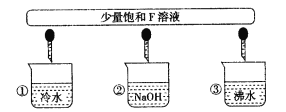
试将①、②、③对应的分散质具体的化学式填人下列方框中:________________
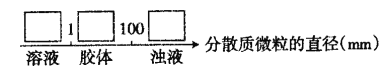
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com