
【题目】几种中学化学常见的单质及其化合物相互转化的关系图如下:
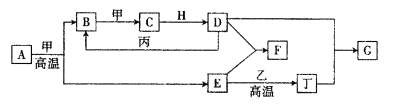
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物
②A由X和Y两种元素组成,其原子个数比为l︰2,元素质量之比为7︰8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为___________,每反应lmol的A转移的电子数为_____________mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式:______________________;
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
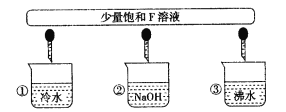
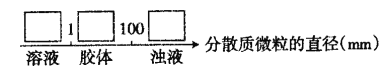
试将①、②、③对应的分散质具体的化学式填人下列方框中:________________
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:________________
【答案】FeS2 11 2Fe3++Fe=3Fe2+ : 分散质微粒的直径(nm); H2O2+2H++2Fe2+=2H2O+2Fe3+
分散质微粒的直径(nm); H2O2+2H++2Fe2+=2H2O+2Fe3+
【解析】
由③中信息可知:B气体是引起酸雨的主要物质,则B为SO2,H常温下为无色无味的液体,则H为H2O;E常用作红色油漆和涂料,故E为Fe2O3,则A中应含Fe、S两种元素。由②可计算得到A的化学式为FeS2,再结合流程图可推知甲为O2,C为SO3,D为H2SO4乙由E(Fe2O3)和乙在高温的条件下生成丁(单质)可知,丁为Fe,D(H2SO4)+E(Fe2O3)→F,则F为Fe2(SO4)3,G为FeSO4,丙可以为S等,乙可以为碳或氢气等。
(1)由上述分析可知,A的化学式为FeS2,高温下燃烧的化学方程式为:
4FeS2+11O2![]() 2Fe2O3+8SO2,由此分析可知,每消耗4molFeS2,转移电子为44mol,即每反应1mol的A(FeS2)转移的电子为11mol,故答案为.:FeS2;11。
2Fe2O3+8SO2,由此分析可知,每消耗4molFeS2,转移电子为44mol,即每反应1mol的A(FeS2)转移的电子为11mol,故答案为.:FeS2;11。
(2)由转化关系图可知F为Fe2(SO4)3,丁为Fe,G为FeSO4,则有关的离子反应为:Fe+2Fe3+=3Fe2+,故答案为:Fe+2Fe3+=3Fe2+;
(3)少量饱和Fe2(SO4)3溶液加入①冷水中形成溶液,溶质为Fe2(SO4)3;加入②NaOH溶液中会产生Fe(OH)3沉淀,形成浊液;加入③沸水中会产生Fe(OH)3胶体,即①Fe2(SO4)3、③Fe(OH)3胶体、②Fe(OH)3沉淀,故答案为: 分散质微粒的直径(nm);
分散质微粒的直径(nm);
(4)化合物M与H(H2O)组成元素相同,则M为H2O2,M在酸性条件下将G(FeSO4)氧化为F[Fe2(SO4)3]的离子方程式为: H2O2+2H++2Fe2+=2H2O+2Fe3+,故答案为:H2O2+2H++2Fe2+=2H2O+2Fe3+。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】实验室用镁还原硝基苯制取反式偶氮苯。实验原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→![]() +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。

⑴在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁条应用砂纸打磨干净的的原因是___________。
⑵反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤,滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要___________(填“缓慢加入”、“快速加入”)。
②烧杯中的反式偶氮苯转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是___________。
A.冰水 B.饱和NaCl溶液
C.95%乙醇水溶液 D.滤液
③抽滤完毕,应先断开___________之间的橡皮管,以防倒吸。
④重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的___________操作除去了不溶性杂质。
⑶薄层色谱分析中,极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮苯,实验开始时和展开后的斑点如图所示,则反式偶氮苯比顺式偶氮苯的分子极性___________(填“强”或“弱”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石膏转化为硫酸钾和CaCl2的工艺流程如下:
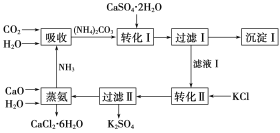
(1)CO2是一种很重要的副产品,工业上获得CO2的途径是_____(用化学方程式表示)。
(2)转化Ⅰ中发生反应的离子方程式为______,过滤Ⅰ得到的滤渣的主要成分是_____。过滤Ⅰ得到的滤液是______,检验滤液中含有CO32-的方法是_______________。
(3)转化Ⅱ中发生反应的化学方程式为_____,转化Ⅱ中可获得K2SO4的原因是___________。
(4)上述工艺流程中体现绿色化学理念的是__________________________。
(5)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是____。
a.熔点较低(29 ℃熔化) b.能制冷 c.无毒 d.能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热定容的密闭容器中,1molA 与 2molB 发生反应 A(g)+2B(g) ![]() xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
A. 充分反应后,放出热量为 b kJ
B. 若 x=1,容器中压强不变时不能判断反应达到平衡
C. 当 B 和 D 的物质的量为 1:1 时,表明该反应已达到平衡
D. 达到平衡过程中,正反应速率可能是先增大再减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(3)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(4)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(5)B、C最高价氧化物的晶体类型是分别是______晶体、______晶体
(6)画出D的核外电子排布图_____________,这样排布遵循了________原理和____________规则。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.H2SO4溶液与氢氧化钠反应:OH-+H+=H2O
B.铝与NaOH溶液反应:Al+2OH-= ![]() +H2↑
+H2↑
C.AlCl3溶液与氨水反应:AlCl3+3OH-=Al(OH)3↓+3Cl-
D.Cl2与氢氧化钠溶液反应:Cl2+2OH-=2ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg、Al和Cu组成的混合物进行下图所示实验,填写下列空白。
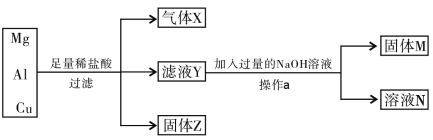
(1)气体X为______,固体Z为______。
(2)滤液Y中除H+外,还含有的阳离子为______和______。
(3)溶液N为______,由滤液Y生成溶液N的离子反应方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、Ⅱ、Ⅲ三个容积均为1 L的恒容密闭容器中均投入1 mol CO2和3 mol H2,在不同温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。反应10 min,测得各容器内CO2的物质的量分别如右图所示。下列说法正确的是
CH3OH(g)+H2O(g)。反应10 min,测得各容器内CO2的物质的量分别如右图所示。下列说法正确的是
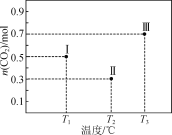
A.该正反应ΔH<0
B.T1时,该反应的平衡常数为![]()
C.10 min内,容器Ⅱ中的平均速率:v(H2)=0.07 mol·L-1·min-1
D.10 min后,向容器Ⅲ中再加入1 mol CO2(g)和1 mol H2O(g),此时v(逆)>v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见的有机物转化关系(部分相关物质和反应条件已略去)。
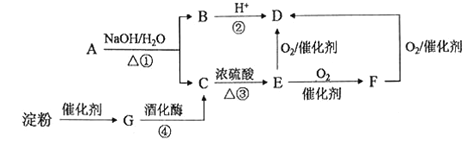
(1)写出E的官能团名称:____________;
(2)③的反应类型为 _______________;
(3)写出反应①的化学方程式:__________________________________;
(4)下列有关上述有机物的说法正确的是____________________。
A.将绿豆大小的钠块投入C中,钠块浮于液面上,并有大量气泡产生
B.可用新制Cu(OH)2鉴别C、D、F三种无色液体(实验过程可加热)
C.G能够发生酯化、水解、氧化、加成等反应
D.相同物质的量的C、E充分燃烧时消耗等量的氧气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com