
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(3)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(4)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(5)B、C最高价氧化物的晶体类型是分别是______晶体、______晶体
(6)画出D的核外电子排布图_____________,这样排布遵循了________原理和____________规则。
【答案】HNO3 NaOH F F 高 因为NH3分子间形成氢键 26 四 d Ⅷ 离子 分子 1s22s22p3 泡利 洪特
【解析】
根据A、B、C、D是四种短周期元素,由A的原子结构示意图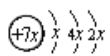 可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素,E是过渡元素,E的外围电子排布式为3d64s2,则E为Fe元素。所以由上述分析可知,A为Si元素,B为Na元素、C为P元素,D为N元素,E为Fe元素。
可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素,E是过渡元素,E的外围电子排布式为3d64s2,则E为Fe元素。所以由上述分析可知,A为Si元素,B为Na元素、C为P元素,D为N元素,E为Fe元素。
(1) 由上述分析可知:五种元素中N的非金属性最强,Na的金属性最强,故最高价氧化物对应水化物酸性最强的是HNO3,碱性最强的是NaOH,故答案为:HNO3;NaOH;
(2)由上述分析可知:D为N元素,属于第二周期,根据同周期自左而右,第一电离能增大(个别除外),所以第一电离能最大的元素是F;同一周期自左而右,电负性逐渐增大,故电负性最大的元素是F,故答案为:F;F;
(3) 由上述分析可知:D为N元素,D的氢化物为NH3,C为P元素,C的氢化物为PH3,因为NH3分子间形成氢键,所以沸点NH3> PH3,故答案:高;因为NH3分子间形成氢键 ;
(4)根据E的外围电子排布式为3d64s2可知,E核电荷数是26,元素在周期表的第四周期第VIII族,价电子排布式为3d64s2,所以位于元素周期表d区,故答案为:26;四;d;
(5) 由上述分析可知:B为Na元素、C为P元素,B、C的最高价氧化物分别为Na2O属于离子晶体,P2O5属于分子晶体,故答案:离子;分子;
(6) 由上述分析可知:D为N元素,D的核外电子排布图1s22s22P3,这样排布是遵循了泡利原理和洪特规则。答案:1s22s22P3;泡利;洪特。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定量的![]() 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应:![]() ,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法正确的是
,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法正确的是

A.![]() 时,若充入惰性气体,
时,若充入惰性气体,![]() 、
、![]() 逆均减小,平衡不移动
逆均减小,平衡不移动
B.![]() 时,反应达平衡后
时,反应达平衡后![]() 的转化率为
的转化率为![]()
C.![]() 时,若充入等体积的
时,若充入等体积的![]() 和CO,平衡向逆反应方向移动
和CO,平衡向逆反应方向移动
D.平衡常数的关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ②
②![]() ③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤
③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥B. ②③⑤C. ②④D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO4在水中的电离方程式为:NaHSO4 = Na+ + H+ + SO42—。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,在一定条件下达平衡,若改变条件,将变化结果(“变大”、“变小”或“不变”)填入空格。
2NH3(g) △H<0,在一定条件下达平衡,若改变条件,将变化结果(“变大”、“变小”或“不变”)填入空格。
(1)化学平衡常数的表达式为 _________。
(2)保持温度和压强不变,充入惰性气体,则NH3的物质的量_______。
(3)保持温度和体积不变,加入惰性气体,则N2的转化率______。
(4)体积不变时,加入N2,则H2的转化率_______。
Ⅱ.已知CO(g) + H2O(g) ![]() CO2 (g) +H2 (g) 800℃ 时K = 1.0 ;在此温度下的恒容体系中,若用CO(g)和H2O(g)的起始浓度均为1mol/L开始反应。
CO2 (g) +H2 (g) 800℃ 时K = 1.0 ;在此温度下的恒容体系中,若用CO(g)和H2O(g)的起始浓度均为1mol/L开始反应。
(1)当CO转化率为40%时,该反应___(填“是”或“否”)达到平衡,此时υ(正)___υ(逆) (填“大于”、“小于”或“等于”)。
(2)达到平衡时,H2O的转化率为_____。
(3)当CO的起始浓度仍为1mol/L,H2O(g)的起始浓度为4mol/L,平衡时H2O的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种中学化学常见的单质及其化合物相互转化的关系图如下:
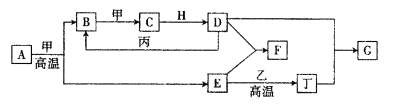
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物
②A由X和Y两种元素组成,其原子个数比为l︰2,元素质量之比为7︰8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为___________,每反应lmol的A转移的电子数为_____________mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式:______________________;
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
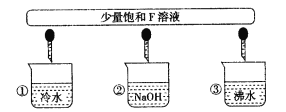
试将①、②、③对应的分散质具体的化学式填人下列方框中:________________
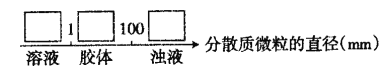
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明氯水的氧化性强于I2
B. 新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明Cl2有漂白性
C. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl﹣
D. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的位置如右图所示, B、C两元素的原子序数之和是A元素原子序数的4倍,各元素对应的物质相互比较,其中关系正确的是
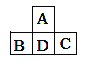
A.原子半径:C>D>AB.单质的熔点:B>C,D>A
C.最高正价:B>D=A>CD.气态氢化物的稳定性:B>C,D>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如图所示。下列说法不正确的是( )

A.a电极反应式是![]()
B.消耗标准状况下![]() 时,被消除的NO2的物质的量为
时,被消除的NO2的物质的量为![]()
C.若离子交换膜是阳离子交换摸,装置右室中溶液的碱性增强
D.整个装置中NaOH的物质的量不断减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com