
【题目】Ⅰ.可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,在一定条件下达平衡,若改变条件,将变化结果(“变大”、“变小”或“不变”)填入空格。
2NH3(g) △H<0,在一定条件下达平衡,若改变条件,将变化结果(“变大”、“变小”或“不变”)填入空格。
(1)化学平衡常数的表达式为 _________。
(2)保持温度和压强不变,充入惰性气体,则NH3的物质的量_______。
(3)保持温度和体积不变,加入惰性气体,则N2的转化率______。
(4)体积不变时,加入N2,则H2的转化率_______。
Ⅱ.已知CO(g) + H2O(g) ![]() CO2 (g) +H2 (g) 800℃ 时K = 1.0 ;在此温度下的恒容体系中,若用CO(g)和H2O(g)的起始浓度均为1mol/L开始反应。
CO2 (g) +H2 (g) 800℃ 时K = 1.0 ;在此温度下的恒容体系中,若用CO(g)和H2O(g)的起始浓度均为1mol/L开始反应。
(1)当CO转化率为40%时,该反应___(填“是”或“否”)达到平衡,此时υ(正)___υ(逆) (填“大于”、“小于”或“等于”)。
(2)达到平衡时,H2O的转化率为_____。
(3)当CO的起始浓度仍为1mol/L,H2O(g)的起始浓度为4mol/L,平衡时H2O的转化率为___。
【答案】![]() 不变 不变 变大 否 大于 50% 20%
不变 不变 变大 否 大于 50% 20%
【解析】
根据题意可知,本题考查化学平衡移动及转化率的计算,运用勒夏特列原理和三段式分析。
Ⅰ.(1)化学平衡常数的表达式为![]()
故答案为:![]() ;
;
(2)保持温度和压强不变,充入惰性气体,则容器体积增大,NH3的浓度减小,但是,NH3物质的量不变。
故答案为:不变;
(3)保持温度和体积不变,加入惰性气体,压强增大,但是物质的浓度均没有改变,平衡没有移动,则N2的转化率不变。
故答案为:不变;
(4)体积不变时,加入N2,增大反应物浓度,平衡向正方向移动,则H2的转化率变大。
故答案为:变大;
Ⅱ.(1)当CO转化率为40%时,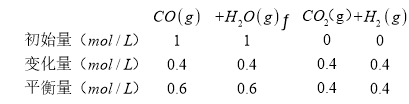
此时浓度商![]() ,所以不是平衡状态,此时反应正向移动,υ(正)大于υ(逆),
,所以不是平衡状态,此时反应正向移动,υ(正)大于υ(逆),
故答案为:否;大于;
(2)(1)设达到平衡时,CO的反应浓度为x,
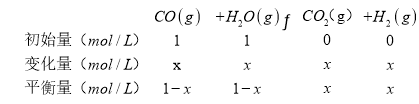
则![]() ,解得x=0.5, H2O的转化率=
,解得x=0.5, H2O的转化率=![]() ,
,
故答案为:50%;
(3)当CO的起始浓度仍为1mol/L,H2O(g)的起始浓度为4mol/L,设平衡时CO的转化率为y,
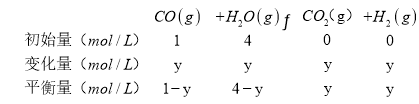
则![]() ,解得y=0.8, H2O的转化率=
,解得y=0.8, H2O的转化率=![]() ,
,
故答案为:20%。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】某小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
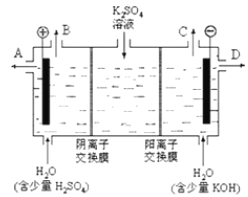
(1)该电解槽的阳极反应为________________________,此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2) 制得的氢氧化钾溶液从出口________(填写“A”、“B”、“C”、“D”)导出,制得的氧气从出口________ (填写“A”、“B”、“C”、“D”)导出。
(3)通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________ 。
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如右图所示,具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是( )

A. 该物质既可看做醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸溶液中存在:CH3COOH![]() CH3COO + H+,改变下列条件能增大醋酸电离度的是( )
CH3COO + H+,改变下列条件能增大醋酸电离度的是( )
①加热;②通入HCl气体;③加NaOH(s);④加CH3COONa(s);⑤加CH3COOH;⑥加水。
A.①③④⑥B.①③⑥C.①②④D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构为:

已知:
有关核黄素的下列说法中,不正确的是:
A.该化合物的分子式为C17H22N4O6
B.酸性条件下加热水解,有CO2生成
C.酸性条件下加热水解,所得溶液加碱后有NH3生成
D.能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(3)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(4)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(5)B、C最高价氧化物的晶体类型是分别是______晶体、______晶体
(6)画出D的核外电子排布图_____________,这样排布遵循了________原理和____________规则。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1______K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
a .容器内N2,H2,NH3的浓度之比为1:3:2 b. υ(N2)正=3υ(H2)逆
c .容器内压强保持不变 d. 混合气体的密度保持不变
③在400℃时,当测得NH3和N2,H2的物质的量分别为1mol和2mol,3mol时,则该反应的υ(N2)正______υ(N2)逆(填写“>,“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)![]() CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ①
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是_______反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是_______反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的ΔH=___________。830℃时反应③的K=1.0,则在催化反应室中反应③的K_______1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH=___________。830℃时反应③的K=1.0,则在催化反应室中反应③的K_______1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有_______。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b电极是_______极。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。回答下列问题:
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是_______。
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则滴定结束时的读数为___________ mL,所用硫酸溶液的体积为_______mL。
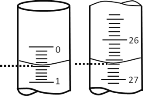
滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1硫酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(3)某学生根据3次实验分别记录有关数据如下表:
依据上表数据计算可得该NaOH溶液的物质的量浓度为___mol·L-1(保留四位有效数字)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____(填字母)。
A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸
B.读取硫酸体积时,开始仰视读数,滴定结束时俯视读数
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.锥形瓶用水洗涤后,用待测液润洗
(5)酸碱中和滴定原理也可用于其它类型的滴定。如:一种测定水样中Br-的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1mL c1 mol/L AgNO3溶液(过量),充分摇匀。
③用c2mol/L KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL。
计算该水样中Br-的物质的量浓度为_______mol·L-1(已知:Ksp(AgBr)= 7.7×10-13,Ag++ SCN-=AgSCN(白色)↓ ,Ksp(AgSCN)= 1×10-12)。
Ⅱ、某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。实验装置如图所示。
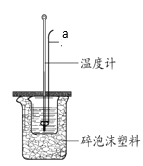
(6)仪器a的名称是_______。
(7)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,测得起止温度差的平均值为4.0℃。近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,和后生成溶液的比热容c=4.18 J/(g·℃)。则计算得中和热ΔH=______(取小数点后一位)。
(8)上述实验结果与-57.3 kJ/mol有偏差,产生偏差的原因可能是_____ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com