
����Ŀ�����ǵ����Ϻ�����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺��ͼ���漰����Ϊ��̬��

��1����ͼ��1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ______��
��2����0.5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��N2��g��+3H2��g��![]() 2NH3��g����H��0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2NH3��g����H��0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t/�� | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
������������⣺
���ԱȽ�K1��K2�Ĵ�С��K1______K2����д����������=��������������
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������_______���������ĸ����
a .������N2��H2��NH3��Ũ��֮��Ϊ1��3��2 b. ����N2����=3����H2����
c .������ѹǿ���ֲ��� d. ���������ܶȱ��ֲ���
����400��ʱ�������NH3��N2��H2�����ʵ����ֱ�Ϊ1mol��2mol��3molʱ����÷�Ӧ������N2����______����N2��������д��������=��������������
���𰸡�NO2��g��+CO��g��=CO2��g��+NO��g����H=��234kJ/mol�� �٣� c ��
��������
��1������1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����Ӧ�ʱ�=134kJ/mol��368kJ/mol=��234kJ/mol����Ӧ���Ȼ�ѧ����ʽΪNO2��g��+CO��g��=CO2��g��+NO��g����H=��234kJ/mol��
��2���ٸ÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���������Ũ�ȼ�С����Ӧ��Ũ����������K1��K2��
��N2��g��+3H2��g��![]() 2NH3��g����H��0����Ӧ�����������С�ķ��ȷ�Ӧ����
2NH3��g����H��0����Ӧ�����������С�ķ��ȷ�Ӧ����
a�������ڸ����ʵ�Ũ��֮�ȵ��ڼ�����֮�ȣ�����֤�����淴Ӧ������ȣ�����˵����Ӧ�ﵽƽ��״̬��
b����ͬ���ʵ����淴Ӧ����֮�ȵ����������֮����ƽ��״̬��3����N2����=����H2������ƽ��״̬������N2����=3����H2������Ӧû�дﵽƽ��״̬��
c��������ѹǿ���䣬��������ʵ������䣬�÷�Ӧ��ƽ��״̬��
d����������ܱ������з�Ӧ���������䣬������䣬�ܶ�ʼ�ղ��䣬��������ܶȲ��䲻��˵����Ӧ�ﵽƽ��״̬��
��ѡc��
��400��ʱ����0.5L�����У�NH3��N2��H2�����ʵ���Ũ�ȷֱ�Ϊ��2mol/L��4mol/L��6mol/L��400��ʱ��Ũ����Qc=![]() =0.0046��K=0.5��˵����Ӧ������У����������N2����������N2������
=0.0046��K=0.5��˵����Ӧ������У����������N2����������N2������


 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��G��Ϊ����������Ԫ�أ���ԭ������������������B�ĵ����ڳ�����Ϊ˫ԭ�ӷ��ӣ�����A�ĵ��ʿ��γɻ�����X��X��ˮ��Һ�ʼ��ԣ�A��Dͬ���壬C��ԭ����������A��Bԭ������֮�ͣ�E�ǵؿ��к�����ߵĽ���Ԫ�أ�FԪ�ص�ԭ�������ȴ�������������ӡ��û�ѧ����ش��������⣺
(1)G��Ԫ�����ڱ��е�λ��Ϊ_______________________��
(2)Ԫ��C��D��E�ļ����ӵİ뾶�ɴ�С��ϵΪ_______________________��
(3)A�ֱ���C��F�γɵ��⻯��е�ϸߵ���_________��ԭ��_______________________��
(4)�õ���ʽ��ʾ������D2C���γɹ���________________________________________��
C��D�����γɻ�����D2C2��D2C2���еĻ�ѧ����_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���һ�̶�������ܱ������У���˵�����淴ӦA (g)��3B (g)![]() 2C (g)�ﵽƽ���˵���У���ȷ�������
2C (g)�ﵽƽ���˵���У���ȷ�������
��C ���������ʺ� C �ķֽ��������
����λʱ�������� a mol A��ͬʱ���� 3a mol B
�������ܶȲ��ٱ仯
�� ��������ƽ����Է�����������
��A��B��C �����ʵ���֮��Ϊ 1��3��2
A.�٢�B.�ڢۢ�C.�٢ܢ�D.�ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ܼ�G��ijҽҩ�м���H��һ�ֺϳ�·����ͼ�����ַ�Ӧ������ȥ����
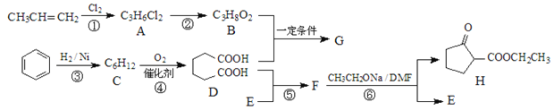
��֪��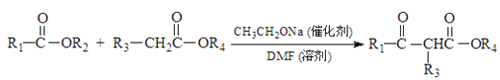 +R2OH
+R2OH
(1)A��������___________________��
(2)д�����з�Ӧ�ķ�Ӧ���ͣ���Ӧ����_____________����Ӧ����__________��
(3)G�Ľṹ��ʽΪ_____________________��F�ķ���ʽΪ_____________________��
(4)д����Ӧ���Ļ�ѧ����ʽ____________________��
(5)C���ڶ���ͬ���칹�壬д���˴Ź�������ֻ�����ַ��ͬ���칹��Ľṹ��ʽ��
____________��
(6)����һ���Լ��Ϳ��Լ���B��D��H�����Լ���____________��
(7)�������Ϻϳ�·�ߵ���Ϣ���Լױ����Ҵ����Ҵ���Ϊԭ�Ϻϳ������л���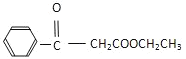 �����Լ���ѡ��___________��
�����Լ���ѡ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ijѧϰС���á���ӵ��������ⶨ����CuCl2��2H2O�������������������I-������Ӧ�������������ʣ��Ĵ��ȣ��������£�ȡ0.800g ��������ˮ���������KI ���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000 mol/L Na2S2O3 ����Һ�ζ�������ζ��յ�ʱ��ƽ������Na2S2O3 ����Һ40.00 mL������֪��2Cu2++4I-=2CuI��+I2��I2+2S2O32-=S4O62-+2I-����
��1����ѡ��________���ζ�ָʾ�����ζ��յ��������________________��
��2����������CuCl2��2H2O �������ٷ���Ϊ________________��
��.25�棬������ĵ���ƽ�ⳣ���������Ҫ��ش��������⡣
K1 | K2 | |
H2SO3 | 1.3��10-2 | 6.3��10-8 |
H2CO3 | 4.2��10-7 | 5.6��10-11 |
��1�������ӷ���ʽ��ʾ����������Һ�ʼ��Ե�ԭ��________________________________��
��2��Ũ�Ⱦ�Ϊ0.1mol/L��Na2SO3��Na2CO3����Һ��SO32-��CO32-��HSO3-��HCO3-Ũ�ȴӴ�С��˳��Ϊ________________________________��
��3������������Һ��ͨ������CO2����Ļ�ѧ����ʽ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ʒ������Ϊ������������������ҽҩ���ܼ����ϳ�a����Ʒ��G��·��֮һ���£�

��֪��RCOOC2H5![]()

��ش��������⣺
�� A���������ŵ�������________________��
�� A���⻯��Z��C7H12O3����д��Z��һ�������¾ۺϷ�Ӧ�Ļ�ѧ����ʽ��
_______________________________________________________________��
�� B�ķ���ʽΪ_________��д��ͬʱ��������������B����״ͬ���칹��Ľṹ��ʽ��_____________��
�� �˴Ź���������2�����շ� �� �ܷ���������Ӧ
(4) B �� C��E �� F�ķ�Ӧ���ͷֱ�Ϊ_____________��_____________��
�� C �� D�Ļ�ѧ����ʽΪ____________________________________________��
�� �Լ�Y�Ľṹ��ʽΪ______________________��
�� ͨ�������µķ�Ӧ������E��F��G���Լ���______________��_____________��
�� G��H2O���ӳɵò�������̼ԭ�ӣ�����4����ͬԭ�ӻ�ԭ���ŵ�̼ԭ�ӽ�����̼ԭ�ӣ��Ļ�����H��д��H�Ľṹ��ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ��ѧ��ѧ�г������ʣ�һ������������֮��������ת����ϵ(������������ȥ)������˵������ȷ����
![]()
A. ��W�ǵ���������Z��Һ������FeCl2��Һ
B. ��W���������ƣ���Xˮ��Һ������
C. ��W����������X��Z����Է��������������48
D. ��W��ǿ�����Եĵ��ʣ���X�����ǽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�ӦCO��g��+H2O��g��![]() CO2��g��+H2��g�����¶�t1ʱ�ﵽƽ�⣬c1��CO����c1��H2O����1��0 mol��L-1����ƽ�ⳣ��ΪK1�������������䣬���߷�Ӧ��ϵ���¶���t2ʱ����Ӧ���ƽ��Ũ�ȷֱ�Ϊc2��CO����c2��H2O����ƽ�ⳣ��ΪK2����
CO2��g��+H2��g�����¶�t1ʱ�ﵽƽ�⣬c1��CO����c1��H2O����1��0 mol��L-1����ƽ�ⳣ��ΪK1�������������䣬���߷�Ӧ��ϵ���¶���t2ʱ����Ӧ���ƽ��Ũ�ȷֱ�Ϊc2��CO����c2��H2O����ƽ�ⳣ��ΪK2����
A��������CO��Ũ�ȣ�K2 ��K1������ B��K2 ��K1
C��c2��CO����c2��H2O�� D�� c1��CO��>c2��CO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ����ԭ�Ӻ��
����ԭ�Ӻ��![]() �İ��ӣ�ʹп����Ǧ���ۺϣ�����һ��112��Ԫ�ص�ԭ�ӵ�ͬʱ�����ͷų�һ�����ӡ�����˵���������
�İ��ӣ�ʹп����Ǧ���ۺϣ�����һ��112��Ԫ�ص�ԭ�ӵ�ͬʱ�����ͷų�һ�����ӡ�����˵���������
A.112��Ԫ�ص����ԭ������Ϊ277
B.�˱仯�����ڻ�ѧ�仯
C.����![]() ��ԭ�Ӻ�����30�����ӣ�40������
��ԭ�Ӻ�����30�����ӣ�40������
D.����![]() �����������������44
�����������������44
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com