
����Ŀ����֪NaHSO4��ˮ�еĵ��뷽��ʽΪ��NaHSO4 = Na+ + H+ + SO42����ij�¶��£���pH=6������ˮ�м���NaHSO4���壬�����¶Ȳ��䣬�����Һ��pHΪ2�����жԸ���Һ�������У�����ȷ���ǣ� ��
A.���¶ȸ���25��
B.��ˮ���������H+��Ũ����1.0��10��10mol��L��1
C.NaHSO4����ļ���������ˮ�ĵ���
D.���¶��¼�������pHΪ12��NaOH��Һ��ʹ����Һǡ�ó�����
���𰸡�D
��������
��������NaHSO4��ˮ�еĵ����֪�����⿼�����ʵĵ��룬�����¶ȡ�Ũ�ȶ�������ʵ���ƽ����ɷ�����
A. pH=6������ˮ�У�c��OH-��=c��H+��=1��10-6mol/L,Kw=1��10-12��1��10-14,˵���¶ȸ���25�棬A����ȷ��
B. ˮ���������c��H+��= c��OH-��=![]() , B����ȷ��
, B����ȷ��
C. NaHSO4 = Na+ + H+ + SO42�����൱����������Ũ�ȣ�����ˮ�ĵ��룬C����ȷ��
D. Kw=1��10-12��
Ӧ��������Ũ��Ϊ0.01mol��L������������Һ����Ӧ��������pH=10��NaOH��Һ����ʹ����Һǡ�ó����ԣ�D�����
��ѡD��


 ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15�֣�ij������ȫ���ҵIJ���ҩ����Ҫ����NaN3��Fe2O3��KClO4��NaHCO3�����ʡ�������������ײʱ������ҩ��������������ʹ����Ѹ�����ͣ��Ӷ��������á�
��1��NaN3�����巢���������ȷֽ����N2��Na��N2�ĵ���ʽΪ ��
��2��Fe2O3��������������Na��Ӧ���ɵĻ�ԭ����Ϊ ����֪�÷�ӦΪ�û���Ӧ��.
��3��KClO4��������������Ӧ��������Na��������KCl��Na2O��KClO4���л�ѧ��������Ϊ ��K��ԭ�ӽṹʾ��ͼΪ ��
��4��NaHCO3����ȴ�������ղ����������ͷŵ������������ֽ⣬�仯ѧ����ʽΪ ��
��5��100g��������ҩ������������ͨ����ʯ�Һ�õ�N2 33.6L����״������
���ü�ʯ�ҳ�ȥ������Ϊ ��
���ò���ҩ����NaN3����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�һ�������½������·�Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)����H����373.2kJ��mol-1���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ��(����)
N2(g)+2CO2(g)����H����373.2kJ��mol-1���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ��(����)
A.�Ӵ���ͬʱ�����¶�B.�Ӵ���ͬʱ����ѹǿ
C.�����¶�ͬʱ����N2D.�����¶�ͬʱ����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���淴ӦaA��bB![]() cC��ij�¶��µ�ƽ�ⳣ��ΪK(K��1)����Ӧ��Ϊ��H�������¶Ȳ��䣬������ʽ����д�����¸ı䣬����H��K��ֵ����Ӧ�仯Ϊ(����)
cC��ij�¶��µ�ƽ�ⳣ��ΪK(K��1)����Ӧ��Ϊ��H�������¶Ȳ��䣬������ʽ����д�����¸ı䣬����H��K��ֵ����Ӧ�仯Ϊ(����)
A.д��2aA��2bB![]() 2cC����Hֵ��Kֵ��������һ��
2cC����Hֵ��Kֵ��������һ��
B.д��2aA��2bB![]() 2cC����Hֵ������һ����Kֵ���ֲ���
2cC����Hֵ������һ����Kֵ���ֲ���
C.д��cC![]() aA��bB����Hֵ��Kֵ��Ϊԭ�����෴��
aA��bB����Hֵ��Kֵ��Ϊԭ�����෴��
D.д��cC![]() aA��bB����Hֵ��Ϊԭ�����෴����Kֵ��Ϊԭ���ĵ���
aA��bB����Hֵ��Ϊԭ�����෴����Kֵ��Ϊԭ���ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹˮ�ĵ���ƽ�����ƣ�����ˮ��Һ�Լ��Ե�������
A. H+ B. OH- C. Al3+ D. HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ���ǣ� ��
A.�������ۼ�����Ϊ0.4NA�İ���(P4)�ͼ�������ʵ������
B.1mol�������Ʒֱ�������CO2��SO2��Ӧ��ת�Ƶĵ�������Ϊ2NA
C.10g��������Ϊ46%���Ҵ�ˮ��Һ�к��е���ԭ������Ϊ1.2NA
D.1molFe(OH)3�뺬3molHI����Һ��ȫ��Ӧ����Һ������I-����ĿΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ɻ�ͭ��(��Ҫ�ɷ�ΪCuFeS2)ұ��ͭ����Ҫ������ͼ��ʾ��
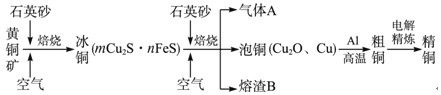
����˵����ȷ���ǣ� ��
A.�ɻ�ͭ��ͭ�ķ�Ӧ�У��������ǿ�������ԭ����CuFeS2
B.����A�еĴ�����Ⱦ�������NaOH��Һ��ˮ����
C.������B��ϡ������ݣ�ȡ����������Һ���μ�KSCN��Һ��ʺ�ɫ��˵������B �е���Ԫ����+3��
D.����ͭ����ͭ�ķ�ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��صļ���װ��ͼ������ʾ��a��b��y��x�缫���Ͼ�Ϊ���Ե缫���ֱ��A��B��ͨ���Ҵ���O2���ø�װ�ý���ʵ�飬����˵����ȷ����( )
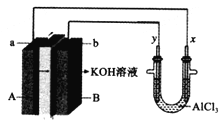
A. a�缫��ӦʽΪC2H5OH+12OH�D�D12e��=2CO2��+9H2O
B. AlCl3��Һ�е��ܷ�ӦΪ2Cl��+2H2O=Cl2��+H2��+2OH��
C. ��Ӧ��ʼ�۲쵽x�缫�������ְ�ɫ����
D. �����ÿͨ��32gO2���Ҳ���ع�����2mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʹ�����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HC1-NH4C1Ϊ�������Һ���������һ�ּ����ṩ���ܣ�����ʵ�ֵ��̶�������ȼ�ϵ�أ�ԭ������ͼ��ʾ�������йط�����ȷ���ǣ� ��

A. ͨ��H2����Ϊ���� B. �����������XΪHC1
C. ��ع���һ��ʱ�����ҺpH��С D. ͨ��N2һ���ĵ缫��ӦʽΪ��N2+6e-+8H+=2NH4+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com