
【题目】(15分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
【答案】8.(15分)
(1)![]() (2)Fe (3)离子键和共价键
(2)Fe (3)离子键和共价键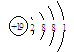
(4)2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(5)①CO2、H2O ② 65%
【解析】
(1)氮原子最外层有5个电子,共用3对电子形成氮气,则N2的电子式为![]() 。
。
(2)因为Fe2O3与Na的反应为置换反应,所以Fe2O3作为氧化剂,与Na反应得电子生成Fe单质。
(3)KClO4 属于含氧酸盐,所以KClO4含有化学键的类型为离子键和共价键,K是19号元素,原子结构示意图为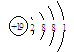
(4)NaHCO3热稳定性较差,受热分解生成碳酸钠、CO2和水,方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(5)①碱石灰的主要成分是NaOH和CaO,所以用碱石灰除去的物质为CO2、H2O;
②标准状况下33.6LN2的物质的量为1.5mol,根据N原子守恒,该产气药剂中NaN3的质量分数为(1.5×2÷3)×65÷100×100%=65%。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是

A. 若A为浓H2SO4,B为Na2SO3,C中盛有Na2SiO3溶液,C中溶液出现白色沉淀,证明非金属性S>Si
B. 若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C. 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,C中先产生白色沉淀后沉淀又溶解
D. 若A为H2O2,B为MnO2,C中盛有Na2S溶液,C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和乙醇的混合气体VL,完全燃烧后生成二氧化碳和水,消耗相同状态下的氧气3VL,则混合气体中乙烯和乙醇的体积比是( )
A. 1∶1B. 2∶1C. 1∶2D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种气态烃.完全燃烧时产生的水和二氧化碳的物质的量之比为1:1.A的相对分子质量小于30.在下图变化中,中间产物C能和新制的氢氧化铜反应生成砖红色沉淀.(反应条件未写出)
又知2CH3CHO+O2![]() 2CH3COOH.请回答下列问题:
2CH3COOH.请回答下列问题:
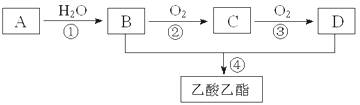
(1)写出A的电子式________
(2)B、D分子内含有的官能团分别是________、________(填名称);
(3)判断下列反应的反应类型:①______________,③______________
(4)写出下列反应的化学方程式:②________________________________________;
(5)下列说法正确的是________。
A.有机物B与金属钠反应,现象是钠浮在液面,不停的游动,最后消失。
B.有机物B、D以及乙酸乙酯可用饱和Na2CO3溶液鉴别
C.反应④中,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是_______(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是_________nm.
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________________________.
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是__________,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,_________、__________(填实验操作)、干燥、称量沉淀质量为43.05g.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是________.
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+.
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+.
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A.请写出上述实验中加入或生成的有关物质的化学式:
①__________;②_________;③__________;④___________.
B.请写出通入⑥的化学方程式_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)CO和NO2是汽车尾气的主要污染物.汽车尾气的反应式之一为:2NO(g)+2CO(g)═N2(g)+2CO2(g).请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
2C(s)+O2═2CO(g)△H=﹣221kJ/mol
则2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=______.
(2)一定温度下,在一体积为VL的密闭容器中充入一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=a mol、n(NO)=2a mol、n(N2)=b mol,且N2占平衡混合气体总价体积的1/4.
①该反应的平衡常数K=______(用只含a、V的式子表示)
②判断该反应达到平衡的标志是______(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0mol NO、2.4mol CO通入固定容积2L的密闭容器中,反应过程中部分物质的物质的量变化如图一所示,

则①有害气体NO的转化率是______,0~15min CO2的平均反应速率v(CO2)=______②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是______(填序号)
A.增加CO2的量 B.加入催化剂 C.降低温度 D.扩大容积体积
(4)通过NOX传感器可监测NOX的含量,其工作原理如图二所示,
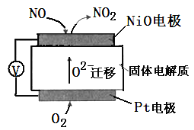
则①Pt电极上发生的是______反应(填“氧化”或“还原”)②NiO电极上的电极反应式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往某酸的钠盐Na2A溶液中通入HCl,溶液中-lg![]() 和-lgc(HA-)或-lg
和-lgc(HA-)或-lg![]() 和-1gc(A2-)的关系如图所示。下列说法正确的是( )
和-1gc(A2-)的关系如图所示。下列说法正确的是( )
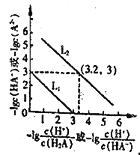
A. 直线L2表示-lg![]() 和-lgc(HA-)的关系
和-lgc(HA-)的关系
B. 通入HCl过程中,水电离的c(OH-)与水电离的c(H+)的乘积不断增大
C. c(H2A)的数量级为10-7
D. 在NaHA溶液中c(Na+)>(HA-)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由12CO和14CO组成的混合气体对氦气的相对密度为7.125,则混合气体中12C和14C的原子个数比为( )
A. 1∶1 B. 1∶2 C. 3∶1 D. 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : l 的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③ C. ①③④ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com