
【题目】(题文)CO和NO2是汽车尾气的主要污染物.汽车尾气的反应式之一为:2NO(g)+2CO(g)═N2(g)+2CO2(g).请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
2C(s)+O2═2CO(g)△H=﹣221kJ/mol
则2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=______.
(2)一定温度下,在一体积为VL的密闭容器中充入一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=a mol、n(NO)=2a mol、n(N2)=b mol,且N2占平衡混合气体总价体积的1/4.
①该反应的平衡常数K=______(用只含a、V的式子表示)
②判断该反应达到平衡的标志是______(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0mol NO、2.4mol CO通入固定容积2L的密闭容器中,反应过程中部分物质的物质的量变化如图一所示,

则①有害气体NO的转化率是______,0~15min CO2的平均反应速率v(CO2)=______②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是______(填序号)
A.增加CO2的量 B.加入催化剂 C.降低温度 D.扩大容积体积
(4)通过NOX传感器可监测NOX的含量,其工作原理如图二所示,
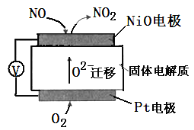
则①Pt电极上发生的是______反应(填“氧化”或“还原”)②NiO电极上的电极反应式为______.
【答案】﹣746.5kJ/mol27V/aBD40%0.027molL﹣1min﹣1CD还原NO+O2﹣﹣2e﹣=NO2
【解析】
(1)①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
②C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
③2C(s)+O2═2CO(g)△H=﹣221kJ/mol;由盖斯定律可知2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=﹣③+2②﹣①=﹣(﹣221KJ/mol )+2×(﹣393.5KJ/mol )﹣180.5KJ/mol=﹣746.5KJ/mol,故答案为:﹣746.5kJ/mol;
(2)①在平衡状态下,c(CO)=![]() mol/L、c(NO)=
mol/L、c(NO)=![]() mol/L、c(N2)=
mol/L、c(N2)=![]() mol/L,c(CO2)=
mol/L,c(CO2)=![]() mol/L,由化学平衡常数的计算式可得K=
mol/L,由化学平衡常数的计算式可得K= =
=![]() ,因N2占平衡混合气体总体积的1/4,则有
,因N2占平衡混合气体总体积的1/4,则有![]() ,化简可得:b=3a;代入可得K=27V/a,故答案为:27V/a;
,化简可得:b=3a;代入可得K=27V/a,故答案为:27V/a;
②A.v(CO2)生成=v(CO)消耗,都体现的正反应,未体现正逆之间的关系,故A错误;B.混合气体的平均相对分子质量不再改变,说明气体的物质的量不变,故B正确;C.混合气体的密度不再改变,体积一定,气体的总质量一定,密度始终是一个定值,故C错误;D.NO、CO、N2、CO2的物质的量浓度均不再变化,说明正逆反应速率相等,达平衡状态,故D正确;故答案为:BD;
(3)①一定温度下,将2.0mol NO、2.4mol CO通入固定容积2L的密闭容器中,依据图象分析可知,平衡状态氮气物质的量为0.4mol,一氧化碳物质的量为1.6mol;依据化学平衡三段式列式计算;
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol) 2 2.4 0 0
变化量(mol) 0.8 0.8 0.4 0.8
平衡量(mol) 1.2 1.6 0.4 0.8
NO的平衡转化率=0.8mol/2mol×100%=40%;0~15min平均反应速率v(CO2)=0.8mol /(2L×15min)=0.027molL﹣1min﹣1;故答案为:40%;0.027molL﹣1min﹣1;
②A.增加CO2的量,平衡逆向,导致CO的浓度变大,故A错误;B.加入催化剂,平衡不移动,故B错误;C.降低温度,平衡正向,导致CO浓度减小,故C正确;D.扩大容积体积,反应物和生成物的浓度都减小,平衡移动的结果,只能减弱减小,但不能抵消,故D正确;故答案为:CD;
(4)①铂电极上氧气得电子生成氧离子而被还原,故答案为:还原;
②NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为:NO+O2﹣﹣2e﹣=NO2,故答案为:NO+O2﹣﹣2e﹣=NO2。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B. 浓硫酸与单质碳反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C. 把足量铜粉投入到含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L
D. 常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸的强氧化性使其钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于取代反应的是
A. 甲烷在空气中燃烧
B. 乙烯通入溴水中
C. 乙醇与乙酸在浓硫酸催化加热的条件下反应
D. 在镍做催化剂的条件下,苯与氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下,n为气体。m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是
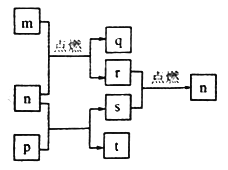
A. 简单离子半径:Z>Y>X B. 化合物P中只存在离子键
C. 图示转化关系涉及的反应均为氧化还原反应 D. 最简单气态氢化物的稳定性:W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸铵固体置于特制的密闭真空容器中(容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列说法中不正确的是
A. 混合气体的平均相对分子质量——M不再随时间变化时反应达平衡状态
B. 15.0 ℃时NH2COONH4(s)分解的平衡常数为2.0×10-9(mol/L)3
C. 该反应H>0,p2=2p1
D. 若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对实验Ⅰ~Ⅳ的实验现象预测正确的是
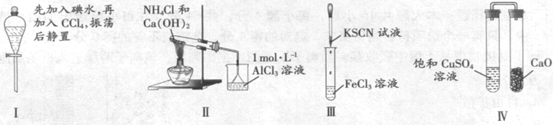
A. 实验I:液体分层,下层呈无色
B. 实验II:烧杯中先出现白色沉淀,后溶解
C. 实验III:试管中溶液颜色变为红色
D. 实验IV:放置一段时间后,饱和硫酸铜溶液中出现蓝色晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的溶度恰好相等,则已反应的Fe3+和未反应的Fe3+的物质的量的比为( )
A.2:1B.2:3C.3:2D.1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com