
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B.1mol过氧化钠分别与足量CO2、SO2反应,转移的电子数均为2NA
C.10g质量分数为46%的乙醇水溶液中含有的氢原子总数为1.2NA
D.1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C.用加热的方法可以除去KCl溶液中的Fe3+
D.为抑制Fe3+的水解,较好地保存FeCl3溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 L含有0.4 mol Cu(NO3)2和0.4 mol KCl的水溶液,用惰性电极电解一段时间后,在一电极上析出19.2 g Cu。此时,在另一电极上放出气体的体积在标准状况下为(不考虑产生的气体在水中的溶解)( )
A.6.72 LB.13.44 LC.3.36 LD.5.6 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO4在水中的电离方程式为:NaHSO4 = Na+ + H+ + SO42—。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《战争的气体化学和分析》中介绍了一种制取rad(光气,熔点为-118℃,沸点为8.2℃,微溶于水,易溶于甲苯等有机溶剂)的方法,其实验装置如图所示(夹持装置已省略),下列说法正确的是( )

A.该反应属于氧化还原反应
B.自来水从冷凝管的X 口通入
C.可将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理
D.装置乙中可收集到光气的甲苯溶液,装置丙、丁中均可收集到液态光气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如图所示:
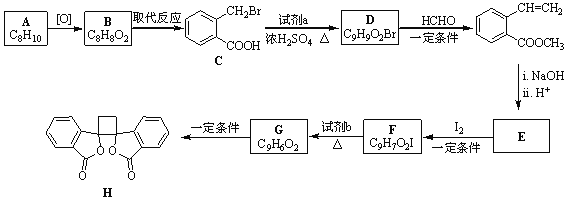
已知:i.RCH2Br![]() R-HC=CH-R’;
R-HC=CH-R’;
ii.R-HC=CH-R’![]() ;
;
iii.R-HC=CH-R’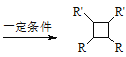 (以上R、R’、R”代表氢原子、烷基或芳基等)
(以上R、R’、R”代表氢原子、烷基或芳基等)
(1)A属于芳香烃,A的名称是___。
(2)由C生成D的化学方程式是___。
(3)由E与I2在一定条件下反应生成F的化学方程式是___;此反应同时生成另外一种与F互为同分异构体的有机副产物(不考虑立体异构),此有机副产物的结构简式是___。
(4)下列说法正确的是___(填字母代号)。
a.G存在顺反异构体
b.由G生成H的反应是加成反应
c.1mo1G最多可以与1mo1H2发生加成反应
d.1mo1F或1mo1H与足量NaOH溶液反应,均消耗2mo1NaOH
(5)试剂b是___。
(6)E有多种同分异构体,其中属于芳香族化合物,并既能发生加聚反应又能发生水解反应的有___种(不考虑立体异构)。写出其中任意一种核磁共振氢谱为5组峰,且峰面积之比为1:1:2:2:2的物质的结构简式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法不正确的是( )
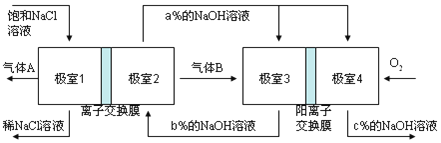
A. 气体B为H2
B. 相同条件下,当电解池生成2L Cl2,理论上燃料电池应消耗1L O2
C. 极室1 与极室2之间的离子交换膜也为阳离子交换膜
D. 溶液a、b、c的pH大小顺序为:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com