
【题目】能使水的电离平衡右移,且其水溶液显碱性的离子是
A. H+ B. OH- C. Al3+ D. HCO3-
科目:高中化学 来源: 题型:
【题目】下表中实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
C | 室温下分别测定NaClO溶液、CH3COONa溶液的pH | 前者大 | 酸性:HClO>CH3COOH |
D | NaHCO3溶液中滴入酚酞 | 溶液变红 | 弱酸的酸式盐溶液均呈碱性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小时候很想知道天天喝的水究竟由啥构成?到了初中又想查查这瓶纯净水(蒸馏水,体积360mL,密度1g/cm3)中有多少个水分子呢?学了“物质的量”这个能在宏观物质和微观粒子之间架起“桥梁”的物理量,实现这个愿望太简单了。请填空:
这瓶纯净水的质量为______ g,含有水分子______个,含有原子总数_____NA个(NA表示阿伏伽德罗常数),若把这些水变成水蒸气再换算到标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。请回答下列问题:
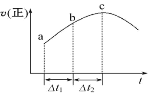
①a~c段反应速率增大的原因是____________。
②有关该反应的说法正确的是________(填字母)。
a.若容器内温度保持不变,可以说明反应达到了平衡状态
b.反应物浓度:a点小于b点
c.反应在c点达到平衡状态
d.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
e.若容器内气体的平均摩尔质量保持不变,可以说明反应达到了平衡状态
(2)利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示。此装置既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。请回答下列问题:
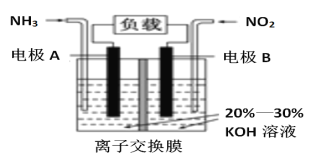
①B电极为______(填“正”或“负”)。
②当有4.48 L NH3(标准状况)参加反应时,转移电子数为________。
③电极A极反应式为______。
④为使电池持续放电,离子交换膜最好选用__________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式,不正确的是
A.工业上可用电解法制备Mg:MgCl2(熔融) ![]() Mg + Cl2↑[
Mg + Cl2↑[
B.向Ca(ClO)2溶液中通入少量CO2:Ca2+ + 2ClO-+H2O+CO2 == 2HClO +CaCO3↓
C.用CaSO4治理盐碱地:CaSO4(s) + Na2CO3(aq) == CaCO3(s) + Na2SO4(aq)
D.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72- + Fe2+ + 14H+ == 2Cr3+ + Fe3+ + 7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)事实证明,原电池中发生的反应通常是放热反应。利用下列化学反应可以设计成原电池的是________(填字母代号)。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极通入的气体为_______(填化学式);负极的电板反应式为_______。
(3)电解原理在化学工业中有着广泛的应用。如图所示的电解池中,a为滴加了少量酚酞的NaCl溶液,X和Y是两块惰性电极板,则电解时,________(填“X”或“Y”)极附近的溶液变红,电解的离子方程式为_______。
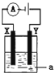
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将久置在空气中的锌粒投人稀硫酸中,测得锌粒和硫酸反应产生氢气的速率v(H2)与反应时间t的关系曲线如图所示。下列推论不正确的是( )

A.O→a段由于是锌粒表面的氧化物与酸的反应,所以未产生气体
B.b→c段产生氢气的速率增大较快的主要原因是温度升高
C.c时刻反应生成的H2的量最多
D.c时刻之后产生氢气的速率减小的主要原因是溶液中c(H+ )减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+3/2 O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2 S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4正确表达式为( )
A. △H4=2/3(△H1+△H2-3△H3) B. △H4=2/3(3△H3-△H1-△H2)
C. △H4=3/2(△H1+△H2+3△H3) D. △H4=3/2(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,氨氧化法是工业生产中制取硝酸的主要途径,某兴趣小组在实验室模拟氨氧化法制硝酸,实验装置如图所示,回答下列问题:

(注:氯化钙可以与NH3反应生成八氨合氯化钙。)
(1)仪器a的名称为________,其中加的试剂为______________。
(2)实验时先点燃C中的酒精灯,当催化剂Cr2O3由暗绿色变为微红时通入空气,3 min后Cr2O3出现暗红色,移去酒精灯,Cr2O3能保持红热状态的原因是________,装置C中发生反应的总反应化学方程式为______________________。
(3)装置D的作用是__________________________;
装置G的作用是______________________。
(4)反应开始后,在装置E中看到的现象是______________________。
(5)实验结束后,证明有HNO3生成的操作是______________________。
(6)为测定所制硝酸的浓度,反应结束后取20 mL装置F中的液体,加水稀释至1000 mL后,取出20 mL加入锥形瓶中,滴加指示剂,然后用0.100 mol/L的NaOH溶液滴定,用去25 mL NaOH溶液,则反应制得的硝酸的浓度为________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com