
【题目】(1)事实证明,原电池中发生的反应通常是放热反应。利用下列化学反应可以设计成原电池的是________(填字母代号)。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极通入的气体为_______(填化学式);负极的电板反应式为_______。
(3)电解原理在化学工业中有着广泛的应用。如图所示的电解池中,a为滴加了少量酚酞的NaCl溶液,X和Y是两块惰性电极板,则电解时,________(填“X”或“Y”)极附近的溶液变红,电解的离子方程式为_______。
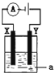
【答案】C O2 H2+2OH--2e-=2H2O X 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
【解析】
(1)能设计成原电池的化学反应必须是自发进行的放热的氧化还原反应;
(2)负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(3)用惰性电极电解氯化钠溶液时,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,据此分析解答。
(1)能设计成原电池的化学反应必须是自发进行的放热的氧化还原反应,则
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,该反应是吸热反应,所以不能设计成原电池,故A不符合;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0,该反应是不是氧化还原反应,所以不能设计成原电池,故B不符合;
C.C.2H2(g)+O2(g)=2H2O(1)△H<0,该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,故C正确;
故答案选C;
(2)原电池中负极发生失去电子的氧化反应,正极发生得到电子的还原反应,则负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2+2OH--2e-=2H2O,正极上通入的是氧气,化学式为O2;
(3)用惰性电极电解氯化钠溶液时,电极Y与电源的正极相连,是阳极,氯离子放电生成氯气,阴极X上氢离子放电生成氢气,阴极周围水的电离平衡被破坏,导致阴极周围氢氧根离子的浓度大于氢离子浓度,所以在阴极X附近的溶液变红,电解的总反应式为2Cl-+2H2O![]() H2↑+Cl2↑+2OH-。
H2↑+Cl2↑+2OH-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对图中的表述中正确的是( )
A.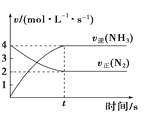 图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
B. 图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
C.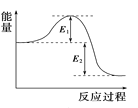 图可表示某化学反应属于放热反应,放出的能量为E1+E2
图可表示某化学反应属于放热反应,放出的能量为E1+E2
D.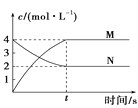 图涉及的反应可能为N(aq)2M(aq)
图涉及的反应可能为N(aq)2M(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。以硫酸工业的尾气、氨水、石灰石、焦炭及氯化钾为原料可以合成有重要用途的硫化钙、硫酸钾、氯化铵、亚硫酸铵等物质。请根据下图中的合成路线回答下列问题:
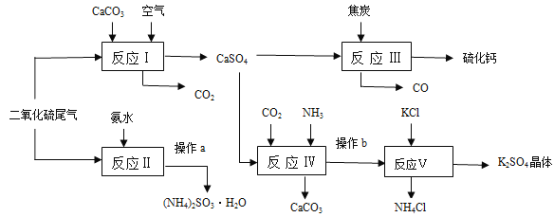
(1)生产中,常向反应II的溶液中加入强还原性的对苯二酚等物质,目的是__________。
(2)操作a中,必须的操作步骤有_______________、___________、过滤等。
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为__________。
(4)写出反应Ⅳ的化学方程式__________________________________________________;操作b所得滤液中阳离子的检验方法是________________。
(5)该生产过程中可以循环使用的物质是_______________。
(6)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式___________________________________________。
(7)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏[M(CaSO4·2H2O)=172],且反应过程中96%的二氧化硫转化为石膏,则可生产石膏______ t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
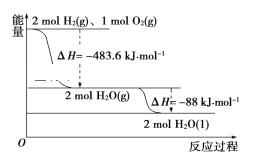
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com