
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 0.1 mol丙烯酸中含有的双键数目为0.1NA
B. 常温常压下,4.6 g NO2和N2O4的混合气体中分子总数为0.3NA
C. 标准状况下,2.24 L Cl2溶于足量的水中充分反应后,溶液中Cl-数为0.2NA
D. 7.8 g Na2O2和Na2S的固体混合物中含有的离子总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色、无味气体。这四种化合物具有如下图所示转化关系(部分反应物、产物及反应条件已略去)。
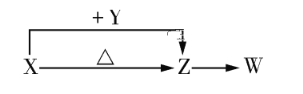
请回答下列问题:
(1)X与Y在溶液中反应的离子方程式是_____________。
(2)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
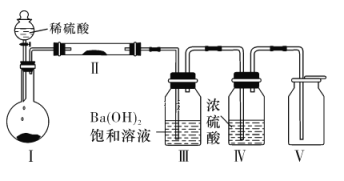
①装置Ⅰ中反应的化学方程式是_______。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净、干燥的装置Ⅴ中的气体,该化合物的化学式是_______,所需仪器装置是_______(从上图选择必要装置,填写编号)。
(3)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的信息,判断下列叙述不正确的是
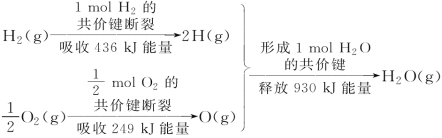
A.1 mol H2的共价键形成放出436 kJ能量
B.氢气跟氧气反应生成水的同时吸收能量
C.1 mol H2(g)跟![]() mol O2(g)反应生成1 mol H2O(g)释放能量245 kJ
mol O2(g)反应生成1 mol H2O(g)释放能量245 kJ
D.1 mol H2(g)与![]() mol O2(g)的总能量大于1 mol H2O(g)的能量
mol O2(g)的总能量大于1 mol H2O(g)的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是
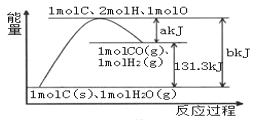
A. 反应物的总能量高于生成物的总能量
B. 2molH和1molO结合生成1molH2O放出热量
C. 1molC和1molH2O反应生成1molCO和1molH2,需要吸收131.3kJ的热量
D. 反应的热化学方程式可表示为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K、101kPa时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )
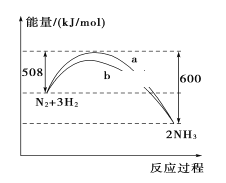
A. 加入催化剂,不能改变该化学反应的反应热
B. b曲线是加入催化剂时的能量变化曲线
C. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
D. 在常温、体积一定的条件下,通入1 mol N2和3 mol H2,反应后放出的热量为92 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2![]() N2O4平衡体系中充入He后,体系颜色变浅
N2O4平衡体系中充入He后,体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期第V A族元素,用化学用语回答问题:
(1)砷的最高价氧化物对应的水化物化学式是 _________,气态氢化物的稳定性ASH3________(填写“大于”或“小于”)NH3。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。雄黄和雌黄的转换关系如图1所示:
①气体物质a是 _____________(填化学式)。
②第I步反应的离子方程式是_________________________________。

(3)Na2HAsO3溶液呈碱性,原因是_______________(用离子方程式表示),该溶液中c(H2AsO3-)______ c(AsO33-) (填“>”、“<”或“=”)。
(4)某原电池装置如图2所示,电池总反应为AsO43-++2I-+H2O![]() AsO33-+I2+ 2OH-。当P池中溶液由无色变蓝色时,正极上的电极反应式为_________;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是__________________。
AsO33-+I2+ 2OH-。当P池中溶液由无色变蓝色时,正极上的电极反应式为_________;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com