
【题目】利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如图所示。下列说法不正确的是( )

A.a电极反应式是![]()
B.消耗标准状况下![]() 时,被消除的NO2的物质的量为
时,被消除的NO2的物质的量为![]()
C.若离子交换膜是阳离子交换摸,装置右室中溶液的碱性增强
D.整个装置中NaOH的物质的量不断减少
【答案】D
【解析】
从所给的化学反应可以看出,NH3中N元素的化合价升高,对应原电池的负极,NO2中N元素的化合价降低,对应原电池的正极。写出两个电极反应进行分析。
A. a电极通入的是NH3,发生氧化反应:电极反应式是2NH3-6e-+6OH-=N2+6H2O,A项正确;
B. 标准状况下时4.48LNH3的物质的量为0.2mol,据得失电子守恒可得4NH3~3NO2,列式得![]() ,解得NO2的物质的量为0.15mol,B项正确;
,解得NO2的物质的量为0.15mol,B项正确;
C. 右室中发生电极反应式为2NO2+8e-+2H2O=N2+4OH-,钠离子透过阳离子交换膜进入右极室,因反应生成OH-,使右室溶液的碱性增强,C项正确;
D. 因电池总反应为6NO2+8NH3=7N2+12H2O,从整体来看并没有NaOH参加反应或生成,所以整个装置中NaOH的物质的量不变,D项错误;
所以答案选择D项。


科目:高中化学 来源: 题型:
【题目】某同学拟用A、C两种有机物合成F(苯乙酸乙酯),合成的路线如图所示:
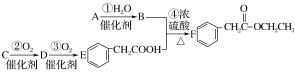
已知:A为最简单的烯烃,C为烃的衍生物,D中含有—CHO。
(1)请写出C的结构简式:________________。
(2)请写出①④的反应类型:①_______________④______________。
(3)请分别写出C、E中官能团的名称:C___________E__________。
(4)写出反应②④的化学方程式:
②__________;
④_________。
(5)J是有机物A的同系物,且比A多1个碳原子,J的加聚产物的结构简式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要用480mL0.1molL-1的硫酸铜溶液,以下配制方法正确的是( )
A. 称取![]() 胆矾(CuSO4·5H2O),配成500mL溶液
胆矾(CuSO4·5H2O),配成500mL溶液
B. 称取![]() 胆矾(CuSO4·5H2O),加入500mL水配成溶液
胆矾(CuSO4·5H2O),加入500mL水配成溶液
C. 称取![]() 无水硫酸铜粉末,加入480mL水配成溶液
无水硫酸铜粉末,加入480mL水配成溶液
D. 称取![]() 无水硫酸铜粉末,加入500mL水配成溶液
无水硫酸铜粉末,加入500mL水配成溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出铜原子价电子排布式:______。与铜同一周期的副族元素原子中最外层电子数与铜原子的相同的元素有________(填元素符号)。
(2)第三周期第一电离能处于Al和P之间的元素有______种。
(3)某种原子的结构示意图为![]() 。则该原子的核电荷数x取值范围为______。
。则该原子的核电荷数x取值范围为______。
(4)Cr在周期表中位于_____周期___族,属于___区,价电子排布图为______
(5)ClO4-互为等电子体的分子或离子为____。
(6)Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.4.6gC2H5OH与6.0gCH3COOH反应,生成的CH3COOC2H3分子数目为0.1NA
B.22gCO2与标准状况下11.2LHF含有相同分子数
C.25℃时,1LpH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
D.32gO2和O3的混合物中含有的氧原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是( )
A. 0.1mol·L-1K2CO3溶液中:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B. 已知Ksp(AgCl)>Ksp(AgBr),将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀多于AgBr沉淀
C. 常温下,pH=4.75、浓度均为0.1mol/L 的CH3COOH、CH3COONa 混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
D. 已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mol/LAgNO3溶液,Cl-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是( )
元素编号 | |||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径 | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 |
|
|
|
|
|
|
最低负化合价 |
|
| 无 |
|
| 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.①元素的氢化物有两种
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____;砷酸的第一步电离方程式为______。
(2)“一级沉砷”中FeSO4的作用是_____;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______。
(3)沉淀X为____(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com