
【题目】下列有关溶液中微粒的物质的量浓度关系不正确的是
A.![]() 溶液与
溶液与![]() 溶液等体积混合:
溶液等体积混合:![]()
B.某温度下,![]() ,
,![]() ;将
;将![]()
![]() 的
的![]() 溶液滴入
溶液滴入![]()
![]() 的KCl和
的KCl和![]()
![]() 的
的![]() 溶液,则先产生
溶液,则先产生![]() 沉淀
沉淀
C.![]()
![]() 溶液与
溶液与![]()
![]() 溶液等体积混合:
溶液等体积混合:![]()
D.在![]()
![]() 氨水中滴加
氨水中滴加![]()
![]() 盐酸,刚好完全中和时
盐酸,刚好完全中和时![]() ,则由水电离产生的
,则由水电离产生的![]()
【答案】B
【解析】
A、因混合后溶液中含等量的NaCl、HAc,醋酸部分电离,溶液呈酸性,所以离子浓度大小为![]() ;
;
B、根据![]() 、
、![]() ,计算
,计算![]() 、
、![]() 开始沉淀时
开始沉淀时![]() 各是多少;
各是多少;
C、![]()
![]() 溶液与
溶液与![]()
![]() 溶液等体积混合中,钠与碳的所有微粒的物质的量之比为3:2,则根据物料守恒:
溶液等体积混合中,钠与碳的所有微粒的物质的量之比为3:2,则根据物料守恒:![]() ;
;
D、刚好完全中和时,氢离子与氢氧根离子浓度相等,![]() 的溶液中
的溶液中![]() 。
。
A、因混合后溶液中含等量的NaCl、HAc,醋酸部分电离,溶液呈酸性,所以离子浓度大小为![]() ,故A不符合题意;
,故A不符合题意;
B、根据![]() 、
、![]() ,则当
,则当![]() 开始沉淀时
开始沉淀时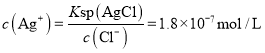 ,当
,当![]() 开始沉淀时
开始沉淀时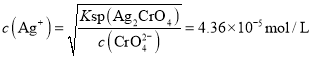 ,故先产生AgCl沉淀,故B符合题意;
,故先产生AgCl沉淀,故B符合题意;
C、![]()
![]() 溶液与
溶液与![]()
![]() 溶液等体积混合中,钠与碳的所有微粒的物质的量之比为3:2,则根据物料守恒:
溶液等体积混合中,钠与碳的所有微粒的物质的量之比为3:2,则根据物料守恒: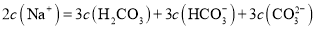 ,故C不符合题意
,故C不符合题意
D、在![]() 氨水中滴加
氨水中滴加![]() 盐酸,刚好完全中和时
盐酸,刚好完全中和时![]() ,则溶液中
,则溶液中![]() ,故D不符合题意;
,故D不符合题意;
故选B。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g·cm-3)配制1mol·L-1的稀硫酸100 mL,现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒。按实验时使用仪器的先后顺序,排列正确的是 ( )
A.②⑥③⑦⑤⑥B.②③⑦⑤⑥C.①③⑤⑦④⑥D.④⑦③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg ![]() 的变化关系如图所示。下列叙述正确的是( )
的变化关系如图所示。下列叙述正确的是( )

A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH-):a<b
C.相同温度下,电离常数K(HX):a>b
D.lg ![]() =3,若同时微热两种溶液,则
=3,若同时微热两种溶液,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置可以模拟铁的电化学腐蚀。下列说法中,正确的是

A. 若X为碳棒,开关K置于M处可以减缓铁的腐蚀
B. 若X为铜棒,开关K置于N处可以加快铁的腐蚀
C. 若X为碳棒,开关K置于M处,则为牺牲阳极的阴极保护法
D. 若X为碳棒,开关K置于N处,则为外加电流的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,1L密闭容器中通入H2和I2各0.016 mol,发生如下反应:H2(g)+I2(g)2HI(g),一段时间后达到平衡,测得数据如下:
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.012 | 0.011 | 0.01 | 0.01 |
请回答:(1)2min内,v(H2) =______mol/(L·min)。
(2)下列能证明该反应已经达到平衡的是______(填字母)。
a.V正(H2)=V逆(HI)
b.混合气体的颜色不再发生变化
c.混合气体中各组分的物质的量不再发生变化
d.混合气体的密度不再变化
(3)该温度下反应的化学平衡常数数值是______。
(4)H2的平衡转化率是______。
(5)温度降低时,该反应的平衡常数变大,则正反应是______(填“放热”或“吸热”)反应。
(6)一定可以提高平衡体系中HI百分含量的措施是____(填字母)。
a.降低温度 b.增大H2浓度 c.加入催化剂 d.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是( )
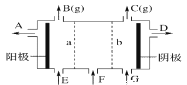
A.b是阳离子交换膜,允许Na+通过
B.从A口出来的是NaOH溶液
C.阴极反应式为4OH--4e-= 2H2O+O2↑
D.Na2SO4溶液从G口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出![]() 中官能团的名称为_________________;
中官能团的名称为_________________;
(2)![]() 的分子式为_____________,1 mol该有机物完全燃烧需消耗氧气的物质的量为________mol,分子中一定共面的原子有________个;
的分子式为_____________,1 mol该有机物完全燃烧需消耗氧气的物质的量为________mol,分子中一定共面的原子有________个;
(3)有机物M(![]() )为苯的同分异构体,M的二氯代物的同分异构体有____种;
)为苯的同分异构体,M的二氯代物的同分异构体有____种;
(4)用系统命名法对下列有机物进行命名:
① CH3C(CH3)=CHCH3:______________;
② CH3CH(CH2CH3)CH(CH3)CH2CH3:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1[
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,
则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
B. NaHSO4在水溶液中的电离方程式:NaHSO4= Na++H++SO42-
C. Na2CO3的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+ H2O![]() H3O++S2-
H3O++S2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com