
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
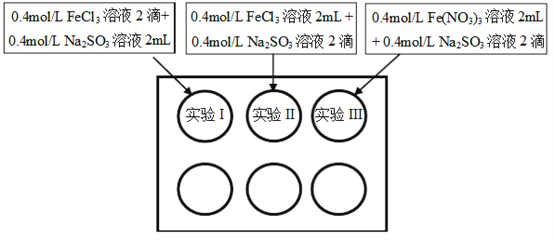
小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
【答案】 Fe3++3H2O![]() Fe(OH)3+3H+ Fe3+起始浓度小,水解出的Fe(OH)3少 Fe3+与SO32-发生了氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42- +2H+,在减小c(Fe2+)的同时降低了pH,使水解出的Fe(OH)3变少 NO3-可以减慢Fe3+与SO32-的氧化还原反应 0.14gNaCl 无明显现象 c
Fe(OH)3+3H+ Fe3+起始浓度小,水解出的Fe(OH)3少 Fe3+与SO32-发生了氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42- +2H+,在减小c(Fe2+)的同时降低了pH,使水解出的Fe(OH)3变少 NO3-可以减慢Fe3+与SO32-的氧化还原反应 0.14gNaCl 无明显现象 c
【解析】(1)FeCl3和Fe(NO3)3均属于强酸弱碱盐,Fe3+在水溶液中发生水解反应显酸性,发生的方程式为:Fe3++3H2O![]() Fe(OH)3+3H+ ,故答案为:Fe3++3H2O
Fe(OH)3+3H+ ,故答案为:Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
(2)开始混合时,实验I中红褐色比II、III中略浅是因为实验I中的Fe3+起始浓度小,水解出的Fe(OH)3少,故答案为:Fe3+起始浓度小,水解出的Fe(OH)3少。
(3)铁氰化钾遇到Fe2+后会与Fe2+生成铁氰化亚铁蓝色沉淀,说明实验II、III中的Fe3+被SO32-还原成了Fe2+,发生反应为2Fe3++SO32-+H2O=2Fe2++SO42- +2H+,pH降低使水解出的Fe(OH)3变少,故答案为:Fe3+与SO32-发生了氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42- +2H+,在减小c(Fe3+)的同时降低了pH,使水解出的Fe(OH)3变少。
(4)根据题干信息,能够影响反应的因素为Cl- 和NO3-,所以还有一种可能的影响因素为:NO3-可以减慢Fe3+与SO32-的氧化还原反应,为了验证具体是哪种影响因素,设计实验V和实验VI进行因素探究。实验V为了验证①Cl- 可以加快Fe3+与SO32-的氧化还原反应;加入的Cl-的物质的量应该与实验II中的Cl-的物质的量相等,所以![]() 加入氯化钠的质量为0.14g。根据实验结论:因素①和因素②均成立,因素③不明显,可知NO3- 在酸性环境下代替Fe3+氧化了SO32-并不能促进Fe3+水解,反而在酸性环境下没有氢氧化铁存在,所以无现象。故答案为:NO3-可以减慢Fe3+与SO32-的氧化还原反应;0.14g NaCl;无明显现象。
加入氯化钠的质量为0.14g。根据实验结论:因素①和因素②均成立,因素③不明显,可知NO3- 在酸性环境下代替Fe3+氧化了SO32-并不能促进Fe3+水解,反而在酸性环境下没有氢氧化铁存在,所以无现象。故答案为:NO3-可以减慢Fe3+与SO32-的氧化还原反应;0.14g NaCl;无明显现象。
(5)a.Fe3+与SO32-不能同时发生水解反应和氧化还原反应,故a错误;b.稀硝酸的氧化性较强,可以将Fe2+氧化,故b错误;c.用稀硝酸和硝酸钡溶液来检验SO42-是一种常用的检验方法,故c正确。


科目:高中化学 来源: 题型:
【题目】某次实验需用450mL、![]() 的H2SO4的溶液,现实验室中有质量分数为98%,密度为1.84g/ml的浓硫酸。
的H2SO4的溶液,现实验室中有质量分数为98%,密度为1.84g/ml的浓硫酸。
请按要求回答下列问题:
(1)实验需要的玻璃仪器除了烧杯、胶头滴管、玻璃棒,还有______。
(2)计算:所需该浓H2SO4的体积为_____ml。
(3)配制过程:
![]() 准确量取一定体积的浓H2SO4
准确量取一定体积的浓H2SO4
![]() 将浓H2SO4沿烧杯壁缓缓注入烧杯中,并搅拌进行稀释
将浓H2SO4沿烧杯壁缓缓注入烧杯中,并搅拌进行稀释
![]() 待烧杯中的溶液冷却后用玻璃棒引流转移到已经检漏的合适规格的容量瓶中
待烧杯中的溶液冷却后用玻璃棒引流转移到已经检漏的合适规格的容量瓶中
![]() 向容量瓶中加入蒸馏水定容,在距离刻度线
向容量瓶中加入蒸馏水定容,在距离刻度线![]() 时,改用胶头滴管加蒸馏水至刻度线
时,改用胶头滴管加蒸馏水至刻度线
![]() 盖好瓶塞,反复上下颠倒,摇匀
盖好瓶塞,反复上下颠倒,摇匀
![]() 将配制好的溶液转移至试剂瓶中待用。
将配制好的溶液转移至试剂瓶中待用。
上述步骤中缺少_______________________,应放在步骤_____之前![]() 填“序号”
填“序号”![]() 。
。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响![]() 选填“偏高”、“偏低”或“无影响”
选填“偏高”、“偏低”或“无影响”![]() 。
。
![]() 量取浓H2SO4体积时,俯视刻度线_______。
量取浓H2SO4体积时,俯视刻度线_______。
![]() 定容时,俯视液面______。
定容时,俯视液面______。
![]() 容量瓶中有少量的水________。
容量瓶中有少量的水________。
④在烧杯中稀释完浓硫酸立即转移至容量瓶中加水定容_______。
⑤定容摇匀后发现液面低于刻度线,又加水至刻度线_______。
(5)下列操作中,容量瓶所不具备的功能有______________![]() 多选
多选![]() 。
。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析细胞内4种重要有机物的组成及功能,回答下列问题:
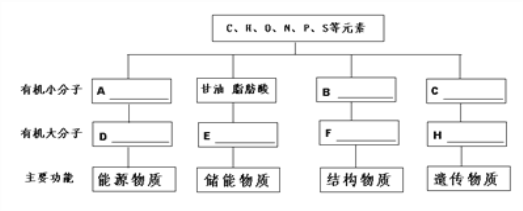
(1)A一般是指_____________;D在动物细胞中是指__________。
(2)E 是指_____________,它还有___________________的功能。
(3)B是指____________,其结构通式是______________,B形成[F]_________ 的过程叫____________。
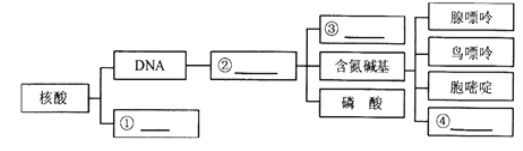
(4)如图中,是指______________,②是指______________,其中③是指___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下黑作坊用病死猪肉腌制的腊肉往往含有大量的细菌,可利用“荧光素——荧光素酶生物发光法”对市场中腊肉含细菌多少进行检测:①将腊肉研磨后离心处理,取一定量上清液放入分光光度计(测定发光强度的仪器)反应室内,加入适量的荧光素和荧光素酶,在适宜条件下进行反应;②记录发光强度并计算ATP含量;③测算出细菌数量。分析并回答下列问题:
(1)荧光素接受____提供的能量后就被激活,在荧光素酶的作用下形成氧化荧光素并且发出荧光。根据发光强度可以计算出生物组织中ATP的含量,原因是发光强度与ATP含量成____________(正比/反比);根据ATP含量进而测算出细菌数量的依据是:每个细菌细胞中ATP含量__________。
(2)“荧光素——荧光素酶生物发光法”中涉及的能量转换是_________;生物细胞中ATP的水解一般与________(吸能反应或放能反应)相联系。
(3)研究人员用不同条件处理荧光素酶后,测定酶浓度与发光强度如图所示。
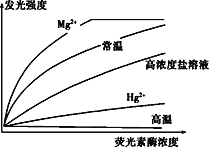
其中高浓度盐溶液经稀释后酶活性可以恢复,高温和Hg2+处理后酶活性不可恢复。若要节省荧光素酶的用量,可以使用____处理;Hg2+处理后酶活性降低可能是因为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是( )
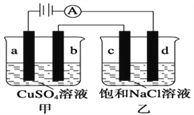
A. 乙烧杯中d的电极反应为 2Cl––2e– =Cl2↑
B. a、c两极产生气体的物质的量相等
C. 乙烧杯中发生的反应为2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
D. 甲、乙两烧杯中溶液的pH均保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质有关性质关系的比较,正确的是( )
A.硬度:SiO2<CO2
B.溶解性:SiO2>CO2
C.熔点:SiO2<CO2(干冰)
D.酸性:H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. “铝热反应”的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是____________________________________________________________。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,当观察到________时,说明熔融物中含有金属铝。
(3)实验室溶解该熔融物,最好选用下列试剂中的____(填字母)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II. 已知固体Na2SO3受热易分解。实验流程和结果如下:
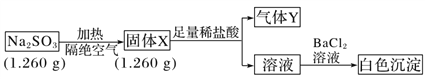
气体Y是一种纯净物,在标准状况下的密度为1.518 g·L-1,请回答:
(4)气体Y分子的电子式______________,白色沉淀的化学式______________。
(5)该流程中Na2SO3受热分解的化学方程式____________________________________。
(6)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式__________________________ (不考虑空气的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池,其原理如图所示。下列说法不正确的是
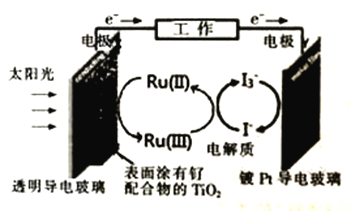
A. 电池工作时,能量的转化形式至少有三种
B. 放电时,I-和I3-的浓度均减小
C. Y电极为电池的正极,发生的反应为:I3-+2e-=3I-
D. 电池工作时,X电极上发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com