
【题目】0.6mol/LNaCl溶液和1mol/LCaCl2溶液的c (Cl﹣)之比为( )
A.2:5
B.3:10
C.1:2
D.3:5
科目:高中化学 来源: 题型:
【题目】根据下列化合物的结构分析回答:
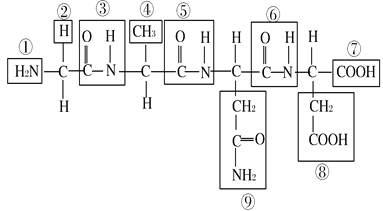
(1) 该化合物中,①表示 ,⑦表示 。
(2) 该化合物由 个氨基酸失去 个水分子而形成,这种反应叫做 。
(3) 该化合物中的氨基酸种类不同,是由 决定的,其编号是 。
(4) 该化合物称为 ,含 个肽键,编号是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
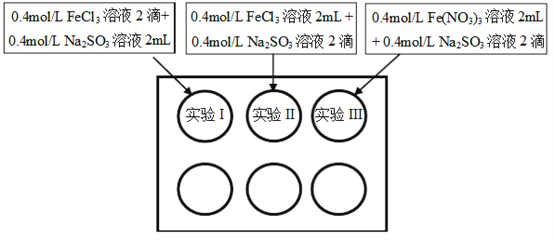
小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
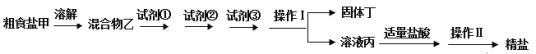
(1)操作Ⅰ需要用到的玻璃仪器有________,操作Ⅱ的名称是________。
(2)试剂①、②、③其实是三种物质:饱和Na2CO3溶液、BaCl2溶液、NaOH溶液,这三种物质的加入顺序可能有多种情况,下列选项中正确的是________。
A.饱和Na2CO3溶液、BaCl2溶液、NaOH溶液
B.BaCl2溶液、饱和Na2CO3溶液、NaOH溶液
C.NaOH溶液、BaCl2溶液、饱和Na2CO3溶液
D.饱和Na2CO3溶液、NaOH溶液、BaCl2溶液
(3)固体丁是混合物,除含有泥沙、CaCO3、BaSO4外,还含有________(填化学式)。
(4)在混合物乙中分别加入试剂①、②、③的过程中,判断滴加BaCl2溶液已过量的方法是:加入BaCl2溶液后,静置,在上层清液中,________。
(5)若先用适量盐酸调节pH值再进行操作Ⅰ,将对实验结果产生影响,其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求,回答下列问题:
(1)相同物质的量的SO2和SO3,所含O的质量之比为________。
(2)标准状况下,4.48 L 的NH3中,所含H的数目约为________。
(3)标准状况下,1 mol H2O、11.2 L CH 4、8 g O2中,体积最小的是________。
(4)某气体的质量为3.4 g,含有6.02×1022个分子,则该气体的摩尔质量为________。
(5)10 mL 0.5 mol·L-1 Al (NO3)3 溶液中NO3-的物质的量浓度为________。
(6)标准状况下,89.6 L HCl 气体溶于1 L水(ρ = 1 g·mL-1)中,所得盐酸的密度为1.146 g·mL-1,则此盐酸的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 为了除去MgCl2酸性溶液中的Fe3+,可在加热条件下加入NaOH溶液
B. 向K2Cr2O7溶液中加入足量浓NaOH溶液,溶液由橙色变成黄色
C. 含有KI和H2SO4的混合溶液放置一段时间后,加入淀粉溶液,溶液变蓝
D. 盐碱地(含较多NaCl、Na2CO3)中加入适量的石膏(CaSO4)可以降低土壤的碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至沉淀刚好完全:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2 H2O
B. AlCl3溶液中加入过量氨水:Al3++4OH-=== ![]() +2H2O
+2H2O
C. 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D. 澄清石灰水和碳酸钠溶液反应:Ca(OH)2+CO32-=CaCO3↓+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快的是
A. v(H2)=0.lmol /(L·min)
B. v(N2) =0.1mol /(L·min)
C. v(NH3)=0.15mol / (L·min)
D. v (N2)=0.02mol /(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com