
【题目】I. “铝热反应”的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是____________________________________________________________。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,当观察到________时,说明熔融物中含有金属铝。
(3)实验室溶解该熔融物,最好选用下列试剂中的____(填字母)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II. 已知固体Na2SO3受热易分解。实验流程和结果如下:
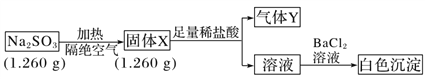
气体Y是一种纯净物,在标准状况下的密度为1.518 g·L-1,请回答:
(4)气体Y分子的电子式______________,白色沉淀的化学式______________。
(5)该流程中Na2SO3受热分解的化学方程式____________________________________。
(6)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式__________________________ (不考虑空气的影响)。
【答案】 该反应温度下铝已熔化,未反应的铝与生成的铁熔合在一起 NaOH溶液 有气泡生成 B ![]() BaSO4 4Na2SO3
BaSO4 4Na2SO3![]() Na2S+3Na2SO4 2S2-+SO
Na2S+3Na2SO4 2S2-+SO![]() +6H+===3S↓+3H2O
+6H+===3S↓+3H2O
【解析】分析:I.(1)当金属铁是液态时,由于金属铝的熔点比铁低,所以金属铝也是液态;
(2)金属铝能和氢氧化钠反应放出氢气而金属铁和氢氧化钠不反应;
(3)既能和金属铁反应又能和金属铝反应的物质是稀硫酸,并且获得的产物无污染。
Ⅱ.固体Na2SO3在隔绝空气的条件下分解,固体的质量不变,说明没有生成气体,加入盐酸生成气体,且溶液加入氯化钡生成白色沉淀,可知固体X为Na2S和Na2SO4混合物,Y为H2S,结合问题解答该题。
详解:I.(1)根据表中的数据可以看出,金属铝的熔点比铁低,当金属铁是液态时,金属铝也是液态,未反应的铝与生成的铁熔合在一起,所以铝热反应得到的是金属铁和金属铝的混合物;
(2)金属铝能和氢氧化钠反应放出氢气而金属铁和氢氧化钠不反应,反应方程式是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,因此可以用氢氧化钠溶液证明上述所得的块状熔融物中含有金属铝;
(3)既能和金属铁反应又能和金属铝反应的物质是稀硫酸,并且获得的产物无污染,浓硫酸在常温下可以和金属铝钝化,稀硝酸可以和金属反应产生有毒的一氧化氮气体,氢氧化钠只和金属铝反应而和金属铁不反应,因此答案选B。
Ⅱ.(4)气体Y是一种纯净物,在标准状况下的密度为1.518 g·L-1,因此相对分子质量是1.518×22.4=34,Y为H2S,属于共价化合物,电子式为![]() ,白色沉淀为硫酸钡,化学式为BaSO4;
,白色沉淀为硫酸钡,化学式为BaSO4;
(5)由以上分析可知Na2SO3受热分解生成Na2S和Na2SO4,根据质量守恒定律可知反应的化学方程式为4Na2SO3![]() Na2S+3Na2SO4;
Na2S+3Na2SO4;
(6)固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,沉淀是单质硫,这是由于在酸性溶液中亚硫酸根离子能氧化硫离子,反应的离子方程式为2S2-+SO32-+6H+=3S↓+3H2O。


科目:高中化学 来源: 题型:
【题目】把纯净的甲烷与氯气混合气放在集气瓶中,用玻璃片盖好瓶口,放在光亮的地方一段时间后,下列说法中,不正确的是
A.气体发生爆炸反应B.瓶内气体的颜色变浅
C.用一根蘸有浓氨水的玻璃棒伸入瓶内时有白烟产生D.集气瓶壁有油状液体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 甲醇、乙二醇、丙三醇都易溶于水且都有毒
B. 含有羟基的化合物属于醇类
C. 苯酚呈弱酸性,不能使石蕊试液显浅红色
D. 酚类和醇类具有相同的官能团, 因而具有相同的化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
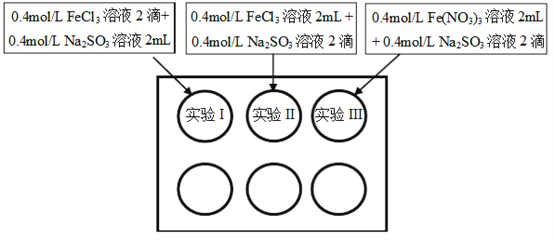
小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是

A. 常温下,PbI的Ksp为2×10-6
B. 温度不变,向PbI饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
C. 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D. 常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数为5×1018
PbS(s)+2I-(aq)的化学平衡常数为5×1018
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
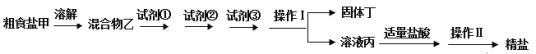
(1)操作Ⅰ需要用到的玻璃仪器有________,操作Ⅱ的名称是________。
(2)试剂①、②、③其实是三种物质:饱和Na2CO3溶液、BaCl2溶液、NaOH溶液,这三种物质的加入顺序可能有多种情况,下列选项中正确的是________。
A.饱和Na2CO3溶液、BaCl2溶液、NaOH溶液
B.BaCl2溶液、饱和Na2CO3溶液、NaOH溶液
C.NaOH溶液、BaCl2溶液、饱和Na2CO3溶液
D.饱和Na2CO3溶液、NaOH溶液、BaCl2溶液
(3)固体丁是混合物,除含有泥沙、CaCO3、BaSO4外,还含有________(填化学式)。
(4)在混合物乙中分别加入试剂①、②、③的过程中,判断滴加BaCl2溶液已过量的方法是:加入BaCl2溶液后,静置,在上层清液中,________。
(5)若先用适量盐酸调节pH值再进行操作Ⅰ,将对实验结果产生影响,其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求,回答下列问题:
(1)相同物质的量的SO2和SO3,所含O的质量之比为________。
(2)标准状况下,4.48 L 的NH3中,所含H的数目约为________。
(3)标准状况下,1 mol H2O、11.2 L CH 4、8 g O2中,体积最小的是________。
(4)某气体的质量为3.4 g,含有6.02×1022个分子,则该气体的摩尔质量为________。
(5)10 mL 0.5 mol·L-1 Al (NO3)3 溶液中NO3-的物质的量浓度为________。
(6)标准状况下,89.6 L HCl 气体溶于1 L水(ρ = 1 g·mL-1)中,所得盐酸的密度为1.146 g·mL-1,则此盐酸的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至沉淀刚好完全:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2 H2O
B. AlCl3溶液中加入过量氨水:Al3++4OH-=== ![]() +2H2O
+2H2O
C. 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D. 澄清石灰水和碳酸钠溶液反应:Ca(OH)2+CO32-=CaCO3↓+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钪(Sc)及其化合物在电子、宇航、超导等方面有着广泛的应用。某工厂的钛白水解工业废酸中,Sc3+浓度为18mg/L,还含有大量的TiO2+、Fe3+、H+、SO42-等。下图为从该工业废酸中提取Sc2O3的一种流程。

回答下列问题:
(1)在钛白水解工业废酸中,加入双氧水是为了使TiO2+转化为难萃取的[Ti(O2)(OH(H2O)4]+。[Ti(O2)(OH(H2O)4]+中Ti的化合价为+4,其中非极性键的数目为_______。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如左下图,应选择的最佳O/A值为_______;温度对钪、钛的萃取率影响情况见右下表,合适的萃取温度为10-15℃,其理由是_____________________。

(3)洗涤“油相“可除去大量的钛离子。洗染水是用浓硫酸、双氧水和水按一定比例混合而成。混合过程的实验操作为________________。
(4)25℃时,用氨水调节滤液的pH,当pH=3.5时,滤渣II的主要成分是_______;当pH=6时,滤液中Sc3+的浓度为________。(Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(5)写出用草酸(H2C2O4)“沉钪”得到Sc2(C2O4)3的离子方程式_____________。
(6)若从1m3该工厂的钛白水解度酸中提取得到24.4gSc2O3,则钪的提取率为______(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com