
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是

A. 常温下,PbI的Ksp为2×10-6
B. 温度不变,向PbI饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
C. 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D. 常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数为5×1018
PbS(s)+2I-(aq)的化学平衡常数为5×1018
【答案】D
【解析】分析:溶液中存在碘化铅的溶解平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),根据外界条件(例如温度、浓度等)对溶解平衡、溶度积常数的影响,结合图像中离子浓度的变化趋势分析解答。
Pb2+(aq)+2I-(aq),根据外界条件(例如温度、浓度等)对溶解平衡、溶度积常数的影响,结合图像中离子浓度的变化趋势分析解答。
详解:A、根据图像知常温下平衡时溶液中c(Pb2+)、c(I-)分别是10-3mol/L、2×10-3mol/L,因此PbI2的Ksp=c(Pb2+)·c2(I-)=4×10-9,A错误;
B、PbI2饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,Pb2+浓度增大,平衡逆向移动,最终平衡时Pb2+浓度仍然比原平衡时大,B错误;
Pb2+(aq)+2I-(aq),温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,Pb2+浓度增大,平衡逆向移动,最终平衡时Pb2+浓度仍然比原平衡时大,B错误;
C、根据图像知T时刻改变的条件是增大碘离子浓度,温度不变,PbI2的Ksp不变,C错误;D、反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数K=c2(I-)/c(S2-)=Ksp(PbI2)/Ksp(PbS)=5×1018,D正确。答案选D。
PbS(s)+2I-(aq)的化学平衡常数K=c2(I-)/c(S2-)=Ksp(PbI2)/Ksp(PbS)=5×1018,D正确。答案选D。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】下图为碳酸氢钠片说明书的部分内容,据此判断该药品可用于( )
(药品名称)碳酸氢钠片
(成 分)碳酸氢钠NaHCO3
(功能主治)用于碱化尿液及酸血症,也可用于缓解胃酸过多引起的胃痛,胃灼烧感(烧心)反酸。
A.镇咳止痰B.抑酸止胃痛C.抗过敏D.抗菌消炎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲中①②③④表示不同化学元素所组成的化合物,图乙表示由四个单体构成的化合物.以下说法不正确的是
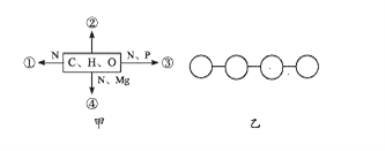
A. 若图甲中的②大量存在于皮下和内脏器官周围等部位,则②最可能是脂肪
B. 图甲中④可以表示叶绿素
C. 图乙中若单体是氨基酸,则该化合物彻底水解需要3分子水
D. 若③为多聚体,且能贮存生物的遗传信息,则③一定是DNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是( )
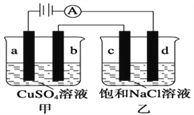
A. 乙烧杯中d的电极反应为 2Cl––2e– =Cl2↑
B. a、c两极产生气体的物质的量相等
C. 乙烧杯中发生的反应为2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
D. 甲、乙两烧杯中溶液的pH均保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置(部分仪器已省略)或操作,能达到相应实验目的的是
A. 闻气体气味 B. 干燥氯气
B. 干燥氯气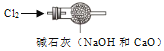
C. 分离乙醇和水 D. 配制100 mL 0.10 molL﹣1盐酸
D. 配制100 mL 0.10 molL﹣1盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. “铝热反应”的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是____________________________________________________________。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,当观察到________时,说明熔融物中含有金属铝。
(3)实验室溶解该熔融物,最好选用下列试剂中的____(填字母)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II. 已知固体Na2SO3受热易分解。实验流程和结果如下:
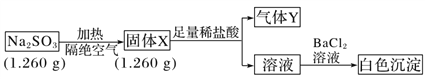
气体Y是一种纯净物,在标准状况下的密度为1.518 g·L-1,请回答:
(4)气体Y分子的电子式______________,白色沉淀的化学式______________。
(5)该流程中Na2SO3受热分解的化学方程式____________________________________。
(6)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式__________________________ (不考虑空气的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种抗病毒药物,在实验室中利用芳香烃A制备H的流程如下图所示(部分反应条件已略去):
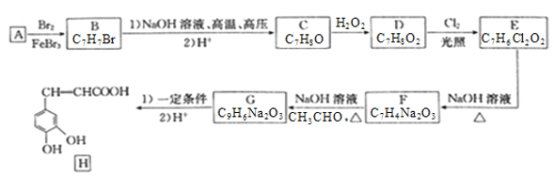
己知:①有机物B苯环上只有两种不同环境的氢原子;
②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基;
③![]() ;
;
④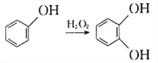 。
。
(1)有机物B的名称为___________________。
(2)由D生成E的反应类型为__________________,E中官能团的名称为__________________。
(3)由G生成H所需的“一定条件”为____________________。
(4)写出B与NaOH溶液在高温高压下反应的化学方程式:___________________________。
(5)F酸化后可得K,X是K的同分异构体,X能发生银镜反应,且其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为1:1:1,写出2种符合条件的X的结构简式:___________________。
(6)设计由![]() 和丙醛合成
和丙醛合成![]() 的流程图:_______________________ (其他试剂任选)。
的流程图:_______________________ (其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸和氢氧化钠溶液反应时溶液的pH变化如图所示。下列说法不正确的是
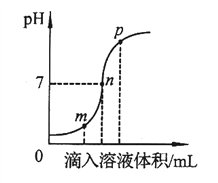
A. m点所示的溶液呈酸性
B. n点所示的溶液中滴加酚酞溶液变红
C. p点所示的溶液中溶质为NaCl和NaOH
D. 该图所对应的操作是将氢氧化钠溶液滴入盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
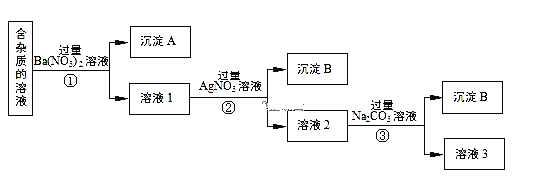
(1)沉淀A的主要成分是__________________________(填化学式)。
(2)②中反应的离子方程式是___________________________________________。
(3)①②③中均进行的分离操作是_______________。
(4)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是__________,为了除去杂质,可向溶液3中加入适量的______________。
(5)实验室用上述实验获得的NaNO3固体配制450 mL 0.40 mol/L NaNO3溶液。该同学需称取NaNO3固体的质量是________ g。
(6)下面是该同学配制过程的示意图,其操作中有错误的是(填操作序号)___________。
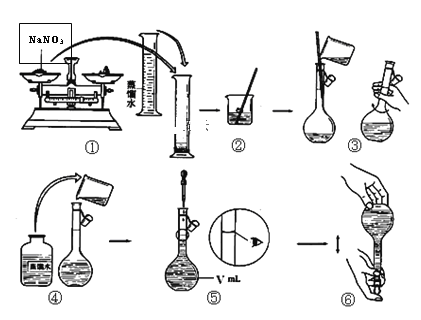
第⑤部操作可能会使所配溶液浓度偏_______(填“大”或“小”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com