
【题目】现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
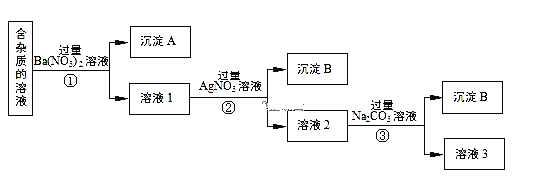
(1)沉淀A的主要成分是__________________________(填化学式)。
(2)②中反应的离子方程式是___________________________________________。
(3)①②③中均进行的分离操作是_______________。
(4)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是__________,为了除去杂质,可向溶液3中加入适量的______________。
(5)实验室用上述实验获得的NaNO3固体配制450 mL 0.40 mol/L NaNO3溶液。该同学需称取NaNO3固体的质量是________ g。
(6)下面是该同学配制过程的示意图,其操作中有错误的是(填操作序号)___________。
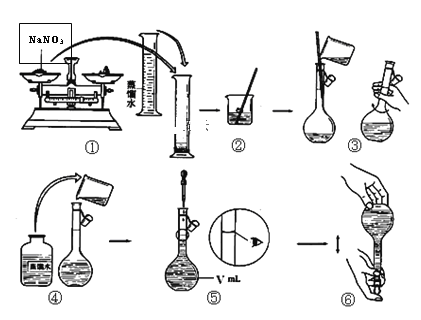
第⑤部操作可能会使所配溶液浓度偏_______(填“大”或“小”或“无影响”)
【答案】BaCO3、BaSO4 Ag+ + Cl-= AgCl↓ 过滤 Na2CO3 稀HNO3 17.0 ①、④、⑤ 小
【解析】
(1)含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液中加入过量的Ba(NO3)2,Na2SO4、Na2CO3和Ba(NO3)2反应生成BaSO4、BaCO3沉淀;
(2)滤液1中含氯离子,加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,反应的离子方程式为:Ag++Cl-═AgCl↓;
(3)①②③中均进行的分离是把不溶性物质和可溶性物质分离,故为过滤;
(4)溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3,最后加热蒸发、冷却结晶、过滤得到硝酸钠,故答案为:Na2CO3;HNO3;
(5)实验室没有450 mL规格的容量瓶,必须配制500mL,制备500mL 0.4mol/L的NaNO3溶液,则需要硝酸钠的质量为0.5L×0.4mol/L×85g/mol=17.0g;
(6)①硝酸钠应该放在纸片上或玻璃片上称量,①不正确;向容量瓶中加入蒸馏水时,应该用玻璃棒引流,④错误;定容时应该平视,⑤不正确,所以答案选①④⑤;
②第⑤步操作可能会使所配溶液浓度偏定容时仰视刻度线,体积偏大,浓度偏小。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是

A. 常温下,PbI的Ksp为2×10-6
B. 温度不变,向PbI饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
C. 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D. 常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数为5×1018
PbS(s)+2I-(aq)的化学平衡常数为5×1018
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去碳酸钠固体中混有的少量碳酸氢钠,最好的方法是( )
A.将固体加热至不再有气体产生
B.将固体配成溶液,再加入过量的澄清石灰水
C.将固体配成溶液,再加入过量的NaOH溶液
D.将固体配成溶液,再通入足量的CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
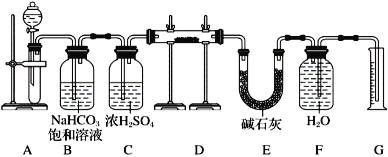
回答下列问题:
(1)连接好装置后需要进行的一步操作是:______,装置C的作用是________,装置E的作用是:____________。
(2)装置D中发生反应的化学方程式是__________、__________。
(3)若开始时测得样品的质量为2.2 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。(保留一位小数点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钪(Sc)及其化合物在电子、宇航、超导等方面有着广泛的应用。某工厂的钛白水解工业废酸中,Sc3+浓度为18mg/L,还含有大量的TiO2+、Fe3+、H+、SO42-等。下图为从该工业废酸中提取Sc2O3的一种流程。

回答下列问题:
(1)在钛白水解工业废酸中,加入双氧水是为了使TiO2+转化为难萃取的[Ti(O2)(OH(H2O)4]+。[Ti(O2)(OH(H2O)4]+中Ti的化合价为+4,其中非极性键的数目为_______。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如左下图,应选择的最佳O/A值为_______;温度对钪、钛的萃取率影响情况见右下表,合适的萃取温度为10-15℃,其理由是_____________________。

(3)洗涤“油相“可除去大量的钛离子。洗染水是用浓硫酸、双氧水和水按一定比例混合而成。混合过程的实验操作为________________。
(4)25℃时,用氨水调节滤液的pH,当pH=3.5时,滤渣II的主要成分是_______;当pH=6时,滤液中Sc3+的浓度为________。(Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31)
(5)写出用草酸(H2C2O4)“沉钪”得到Sc2(C2O4)3的离子方程式_____________。
(6)若从1m3该工厂的钛白水解度酸中提取得到24.4gSc2O3,则钪的提取率为______(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,CaCO3在水中的溶解平街曲线如阳所示。已知25℃其浓度积为2.8×10-9mol2/L2,下列说法不正的是( )
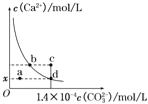
A. x数值为2×10-5 B. c点时有碳酸钙沉淀生成
C. 加入蒸馏水可使溶液由d 点变到a点 D. b点与d对应的的溶度积相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com