
【题目】下列各组物质有关性质关系的比较,正确的是( )
A.硬度:SiO2<CO2
B.溶解性:SiO2>CO2
C.熔点:SiO2<CO2(干冰)
D.酸性:H2CO3>H2SiO3
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】下图甲中A、B、D分别表示细胞内的三种大分子有机物,a、b、d分别表示能组成这三种大分子的基本单位,图乙是核苷酸的结构示意图。请据图回答:

(1)物质a的名称是_____,a分子之间通过_____的方式形成A。
(2)如果物质D是动物肝细胞的储能物质,则物质D是_____。
(3)若图乙表示图甲中物质b的结构,则图乙所示物质的名称是_____。
(4)若图乙所示物质能参与ATP的组成,则物质m的名称是_____。
(5)物质a、b、d都以_____为基本骨架。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气广泛应用于化工、轻工、化肥、制药、合成纤维等领域。
(1)在三个1L的恒容密闭容器中,分別加入0.10molN2和0.30molH2发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g) △H<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
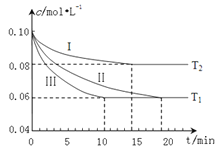
①与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件为_________、_________。
②实验Ⅲ在0~10 min的平均反应速率v(H2)=_________。
(2)分别以N2、H2为电极反应物,HCl-NH4Cl为电解质溶液制造新型燃料电池,试写出该电池正极的电极反应式:______________________。
(3)常温下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应达平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=_________。
(4)工业上用NH3消除NO、NO2 污染。当n(NO)∶n(NO2) =1∶1时,在高温及催化剂条件下,每生成1mol N2放出热量akJ,请书写该反应的热化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
A. 硫酸亚铁的电离方程式:Fe2(SO4)3 =2Fe3++3SO42-
B. H2SO4的电离方程式:H2SO4=H2+ + SO42-
C. 质子数为6,中子数为7的微粒:76C
D. 钠离子的结构示意图:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
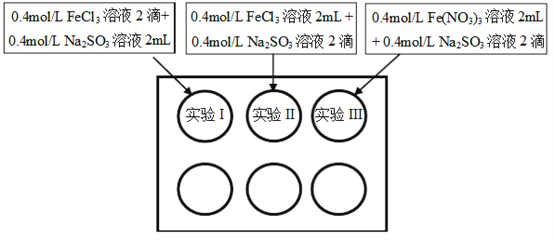
小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生的化学反应方程式________________。
(2)此电池的正极发生的电极反应式是_______________;负极发生的电极反应式是_________。
(3)电解液中的![]() 离子向__________极移动;向外电路释放电子的电极是__________。
离子向__________极移动;向外电路释放电子的电极是__________。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
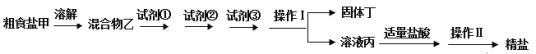
(1)操作Ⅰ需要用到的玻璃仪器有________,操作Ⅱ的名称是________。
(2)试剂①、②、③其实是三种物质:饱和Na2CO3溶液、BaCl2溶液、NaOH溶液,这三种物质的加入顺序可能有多种情况,下列选项中正确的是________。
A.饱和Na2CO3溶液、BaCl2溶液、NaOH溶液
B.BaCl2溶液、饱和Na2CO3溶液、NaOH溶液
C.NaOH溶液、BaCl2溶液、饱和Na2CO3溶液
D.饱和Na2CO3溶液、NaOH溶液、BaCl2溶液
(3)固体丁是混合物,除含有泥沙、CaCO3、BaSO4外,还含有________(填化学式)。
(4)在混合物乙中分别加入试剂①、②、③的过程中,判断滴加BaCl2溶液已过量的方法是:加入BaCl2溶液后,静置,在上层清液中,________。
(5)若先用适量盐酸调节pH值再进行操作Ⅰ,将对实验结果产生影响,其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 为了除去MgCl2酸性溶液中的Fe3+,可在加热条件下加入NaOH溶液
B. 向K2Cr2O7溶液中加入足量浓NaOH溶液,溶液由橙色变成黄色
C. 含有KI和H2SO4的混合溶液放置一段时间后,加入淀粉溶液,溶液变蓝
D. 盐碱地(含较多NaCl、Na2CO3)中加入适量的石膏(CaSO4)可以降低土壤的碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种等体积等物质的量浓度的NaOH溶液。若将甲蒸发一半水,在乙中通入少量CO2,丙不变,然后用等浓度的H2SO4溶液滴定,用甲基橙作指示剂。完全反应后,所需溶液体积是( )
A.甲=丙>乙 B.丙>乙>甲 C.乙>丙>甲 D.甲=乙=丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com