
【题目】下列化学用语表示正确的是
A. 硫酸亚铁的电离方程式:Fe2(SO4)3 =2Fe3++3SO42-
B. H2SO4的电离方程式:H2SO4=H2+ + SO42-
C. 质子数为6,中子数为7的微粒:76C
D. 钠离子的结构示意图:
【答案】D
【解析】
A. 区分出硫酸亚铁与硫酸铁的化学式,硫酸亚铁的化学式中含有1个亚铁离子和1个硫酸根离子;
B.氢离子不能合并,2个氢离子的表示方法错误;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.钠离子的核电荷数为11,核外电子数为10。
A.硫酸亚铁的化学式为FeSO4,因此其电离方程式:FeSO4 =Fe2++SO42-,故A项错误;
B.硫酸为强酸,在溶液中完全电离,其电离方程式为:H2SO4=2H+ +SO42-,故B项错误;
C.质子数为6,中子数为7的C原子的质量数为13,该原子的表示方法为:![]() ,故C项错误;
,故C项错误;
D.钠离子的核电荷数为11,核外电子总数为10,最外层达到8电子稳定结构,其离子结构示意图为:![]() ,故D项正确;
,故D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】金刚烷(![]() )可看成由四个椅式环己烷(
)可看成由四个椅式环己烷(![]() )构成。下列说法正确的是( )
)构成。下列说法正确的是( )
A. 金刚烷的分子式为C10H14
B. 金刚烷的二溴代物有6种
C. 金刚烷能被酸性KMnO4溶液氧化
D. 金刚烷的同分异构体中有可能存在苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清代《本草纲目拾遗》中关于“鼻冲水(氨水)”的记载明确指出:“鼻冲水,……贮以玻璃瓶,紧塞其口,勿使泄气,则药方不减……唯以此水瓶口对鼻吸其气,即遍身麻颤出汗而愈,虚弱者忌之。宜外用,勿服。”下列有关“鼻冲水”的推断不正确的是
A. 鼻冲水是弱电解质
B. 鼻冲水滴入酚酞溶液中,溶液变红色
C. 鼻冲水中含有分子和离子的种类为6种
D. 存在平衡:NH3 + H2O ![]() NH3·H2O
NH3·H2O ![]() NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象是造成有机物种类繁多的重要原因之一。下列互为同分异构体的是
A.甲烷与丙烷B.乙醇与乙酸
C.乙烯与乙烷D.CH3CH2CH2CH3与CH3CH(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下黑作坊用病死猪肉腌制的腊肉往往含有大量的细菌,可利用“荧光素——荧光素酶生物发光法”对市场中腊肉含细菌多少进行检测:①将腊肉研磨后离心处理,取一定量上清液放入分光光度计(测定发光强度的仪器)反应室内,加入适量的荧光素和荧光素酶,在适宜条件下进行反应;②记录发光强度并计算ATP含量;③测算出细菌数量。分析并回答下列问题:
(1)荧光素接受____提供的能量后就被激活,在荧光素酶的作用下形成氧化荧光素并且发出荧光。根据发光强度可以计算出生物组织中ATP的含量,原因是发光强度与ATP含量成____________(正比/反比);根据ATP含量进而测算出细菌数量的依据是:每个细菌细胞中ATP含量__________。
(2)“荧光素——荧光素酶生物发光法”中涉及的能量转换是_________;生物细胞中ATP的水解一般与________(吸能反应或放能反应)相联系。
(3)研究人员用不同条件处理荧光素酶后,测定酶浓度与发光强度如图所示。
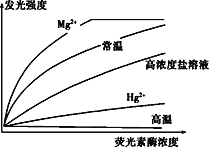
其中高浓度盐溶液经稀释后酶活性可以恢复,高温和Hg2+处理后酶活性不可恢复。若要节省荧光素酶的用量,可以使用____处理;Hg2+处理后酶活性降低可能是因为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系不正确的是( )
A. 0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B. 1 L浓度均为 0.1 mol·L-1 CuSO4、(NH4)2SO4的混合溶液中:c(SO![]() )>c(NH)>c(Cu2+)>c(H+)>c(OH-)
)>c(NH)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1 mol·L-1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO![]() )+c(OH-)
)+c(OH-)
D. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质有关性质关系的比较,正确的是( )
A.硬度:SiO2<CO2
B.溶解性:SiO2>CO2
C.熔点:SiO2<CO2(干冰)
D.酸性:H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现欲配制500 mL 0.040 mol·L-1的K2Cr2O7溶液。
(1)所需的仪器有:托盘天平、药匙、烧杯、________、________、________。(在横线上填写所缺仪器的名称)
(2)在溶液的配制过程中,有以下基本实验步骤,正确的操作顺序是(填写操作步骤的代号,每个操作步骤只用一次)________。
①颠倒摇匀 ②定容 ③洗涤 ④溶解 ⑤转移 ⑥称量
(3)用托盘天平称取K2Cr2O7固体的质量为________ g。
(4)下列操作使最后实验结果偏小的是________(填序号)。
A.加水定容时俯视刻度线 B.转移前,容量瓶中含有少量蒸馏水未干燥
C.未洗涤烧杯内壁和玻璃棒 D.摇匀后发现凹液面低于刻度线又加水补上
(5)定容时,如果不小心加水超过了刻度线,则处理的方法是________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol/L的NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol/L的HCl溶液和HX溶液,溶液的pH随加入 NaOH溶液体积的变化如图所示。下列说法正确的是
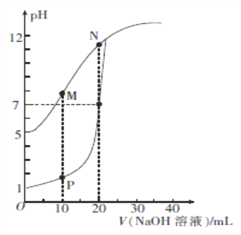
A. HX的电离平衡常数Ka约为1×10-5
B. M点对应溶液中:c(HX)< c (X-)
C. P点对应溶液中: c(Cl-)=0.05mol/L
D. N点对应溶液中:c(Na+)>c(X-)>c(OH-) >c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com