
【题目】一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+![]() O2+14e-=14OH-
O2+14e-=14OH-
有关此电池的推断错误的是( )
A.通乙烷的电极为负极
B.参加反应的O2与C2H6的物质的量之比为7:2
C.放电一段时间后,KOH的物质的量浓度将下降
D.在电解质溶液中CO32-向正极移动
【答案】D
【解析】
A.通入燃料的电极是负极、通入氧气的电极是正极;
B.根据得失电子相等确定氧化剂和燃料的物质的量之比;
C.其电池反应式为C2H6+4OH-+![]() O2=2CO32-+5H2O,KOH的物质的量减少、溶液体积增大;
O2=2CO32-+5H2O,KOH的物质的量减少、溶液体积增大;
D.放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动。
A.在燃料电池中,燃料失电子发生氧化反应、氧化剂得电子发生还原反应,所以通入燃料的电极是负极、通入氧化剂的电极是正极,A正确;
B.电池反应式为C2H6+4OH-+![]() O2=2CO32-+5H2O,则参加反应的氧气与C2H6的物质的量之比为7:2,B正确;
O2=2CO32-+5H2O,则参加反应的氧气与C2H6的物质的量之比为7:2,B正确;
C.电池反应式为C2H6+4OH-+![]() O2=2CO32-+5H2O,KOH的物质的量减少、溶液体积增大,所以KOH的物质的量浓度减小,C正确;
O2=2CO32-+5H2O,KOH的物质的量减少、溶液体积增大,所以KOH的物质的量浓度减小,C正确;
D.放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,所以碳酸根离子向负极移动,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】硒(Se)和碲(Te)有许多优良性能,被广泛用于冶金、化工、医药卫生等领域。工业上以铜阳极泥(含有Cu、Cu2S、Cu2Se、Cu2Te等)为原料制备硒和碲的一种生产工艺如下图所示:
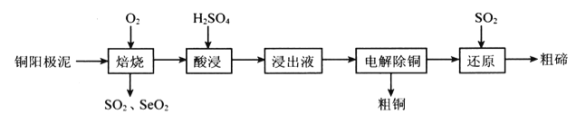
已知:“酸浸”过程中TeO2与硫酸反应生成TeOSO4。
(1)焙烧时通入氧气使铜阳极泥沸腾,目的是________________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,该反应中氧化产物与还原产物的物质的量之比为_____________。已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.6×10-7,NaHSeO3溶液的pH________7(填“>”、“<”或“=”),理由是____________________。
(3)“浸出液”的溶质成分除了TeOSO4外,还有_______________。上述整个流程中可以循环使用的物质是___________________。
(4)“还原”步骤中生成Te的化学方程式为_______________________;Te也可以通过碱性环境下电解Na2TeO3溶液获得,其阴极的电极反应式为___________________。
(5)粗硒中硒的含量可用如下方法测定:
①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;
②SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
③I2+2Na2S2O3=Na2S4O6+2NaI
通过用Na2S2O3标准溶液滴定反应②中生成的I2来计算硒的含量。实验中准确称量0.1200 g粗硒样品,滴定中消耗0.2000 mol·L-1Na2S2O3溶液24.00 mL,则粗硒样品中硒的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
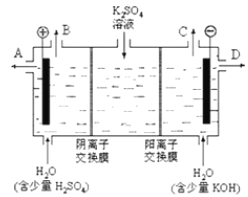
(1)该电解槽的阳极反应为________________________,此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2) 制得的氢氧化钾溶液从出口________(填写“A”、“B”、“C”、“D”)导出,制得的氧气从出口________ (填写“A”、“B”、“C”、“D”)导出。
(3)通电开始后,阴极附近溶液pH会增大,请简述原因_______________________________ 。
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
a | |||||||||||||||||
f | h | i | |||||||||||||||
b | e | j | |||||||||||||||
c | d | g | k | ||||||||||||||
l | |||||||||||||||||
(1)请写出d元素的原子结构示意简图:___________________________________;
(2)请写出i的单质与a、h形成的化合物发生反应的化学方程式_______________________;
(3)请写出上述元素组成的物质间发生的与“(2)”反应类型相同且有固体非金属单质生成的化学反应方程式________________________________________________;
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出g元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式:______________________________________________________;
(5)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出j、k的互化物与c、l形成的化合物等物质的量反应时的化学方程式________________。
(6)用电子式表示c、h两种元素以原子个数比1:1形成化合物的形成过程:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液加入0.2molCuO,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为( )
A.0.1molB.0.2molC.0.3mo1D.0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如右图所示,具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是( )

A. 该物质既可看做醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸溶液中存在:CH3COOH![]() CH3COO + H+,改变下列条件能增大醋酸电离度的是( )
CH3COO + H+,改变下列条件能增大醋酸电离度的是( )
①加热;②通入HCl气体;③加NaOH(s);④加CH3COONa(s);⑤加CH3COOH;⑥加水。
A.①③④⑥B.①③⑥C.①②④D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g)![]() CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ①
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是_______反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是_______反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的ΔH=___________。830℃时反应③的K=1.0,则在催化反应室中反应③的K_______1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH=___________。830℃时反应③的K=1.0,则在催化反应室中反应③的K_______1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有_______。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b电极是_______极。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com