



 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
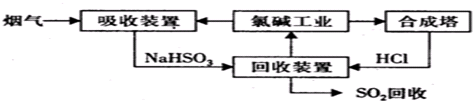
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| C2(NO2) |
| C(N2)C2(O2) |
查看答案和解析>>
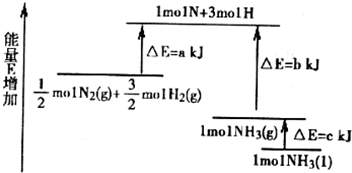
科目:高中化学 来源: 题型:
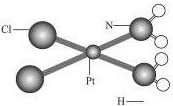 顺铂[化学名称为顺二氯二氨合铂(Ⅱ),化学式为PtCl2(NH3)2]是一种用于治疗癌症的药物,它的分子结构可用如图表示,一片顺铂药片所含顺铂的质量为0.3mg,那么:
顺铂[化学名称为顺二氯二氨合铂(Ⅱ),化学式为PtCl2(NH3)2]是一种用于治疗癌症的药物,它的分子结构可用如图表示,一片顺铂药片所含顺铂的质量为0.3mg,那么:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
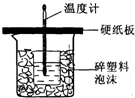 50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:
50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X离子的半径比Z离子的半径大 |
| B、Y的氧化物是良好的半导体材料 |
| C、Z的氢化物比W的氢化物的还原性更强 |
| D、X和W的化合物中含有共价键和离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com