
| 离子 | H+ | Cl- | Fe2+ | Fe3+ |
| 浓度(mol/L) | 0.16 | 0.94 | 0.12 |
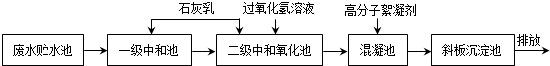
分析 (1)根据废水中含有H+、Cl-、Fe2+、Fe3+等,其中氢离子成酸性会腐蚀水利设施,Fe3+具有强氧化性会影响水生生物的自然生长;
(2)石灰乳与盐酸反应生成氯化钙和水;
(3)过氧化氢的主要作用氧化剂;
(4)根据溶液中电荷守恒计算.
解答 解:(1)因为废水中含有H+、Cl-、Fe2+、Fe3+等,其中氢离子成酸性会腐蚀水利设施,Fe3+具有强氧化性会影响水生生物的自然生长,
故答案为:ab;
(2)石灰乳与盐酸反应生成氯化钙、水和二氧化碳,方程式为:Ca(OH)2+2HCl═CaCl2+2H2O,
故答案为:Ca(OH)2+2HCl═CaCl2+2H2O;
(3)过氧化氢具有较强的氧化性主要作用氧化剂,
故选:b;
(4)根据溶液中电荷守恒得,c(Fe2+)=$\frac{0.94×1-0.16×1-0.18×3}{2}$=0.12mol/L,故答案为:0.12.
点评 本题考查工业上处理高浓度酸性含铁废水的工艺流程,题目难度中等,本题注意把握题给信息,结合物质基本性质解答,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.2mol | C. | 0.15mol | D. | 0.22mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮原子电子排布图为: | |
| B. | S2-的结构示意图: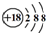 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 氯化钠的电子式: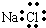 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是极性分子 | B. | 中心原子都采取sp杂化 | ||
| C. | SO2为V形结构,CO2为直线形结构 | D. | S原子和C原子上都没有孤电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
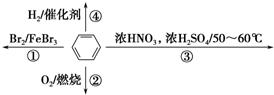
| A. | 反应①为取代反应,有机产物浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并伴有浓烟 | |
| C. | 反应③为取代反应,只生成一种产物 | |
| D. | 反应④中1 mol苯最多与3 mol H2发生加成反应,因为苯分子含有3个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、O2、NO2 | B. | N2、O2、H2 | C. | NO、O2、NH3 | D. | HBr、NH3、Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH | B. | C2H5OH | C. | HO-CH2CH2-OH | D. | CH3CH2CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com