
| A. | 0.1mol | B. | 0.2mol | C. | 0.15mol | D. | 0.22mol |
分析 铜与硝酸反应中硝酸呈酸性和氧化性,所以所消耗硝酸的物质的量是两者之和.
解答 解:n(Cu)=$\frac{m(Cu)}{M(Cu)}$=$\frac{3.2g}{64g/mol}$=0.05mol铜粉生成硝酸铜,要消耗2×0.05mol=0.1mol的硝酸;2.24L气体是NO和NO2的混合物,物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,则所消耗的硝酸为0.1+0.1=0.2mol,
故选B.
点评 本题考查化学方程式的计算,难度不大,注意浓硝酸和稀硝酸的性质的不同,明确二氧化氮或一氧化氮和硝酸的关系以及铜与硝酸(表现酸性)的关系式是解本题的关键.


科目:高中化学 来源: 题型:实验题
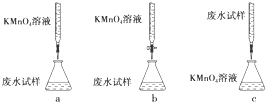
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、AlO2-、NO3-、Cl- | B. | Cl-、HCO3-、OH-、Na+、SO42- | ||
| C. | Ba2+、OH-、Cl-、K+、NO3- | D. | Fe2+、H+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,则氢气燃烧热为285.8kJ•mol-1 | |
| C. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 已知2SO2(g)+O2(g)?2SO3(g);△H=-QkJ•mol-1(Q>0),则将128gSO2(g)和足量O2置于一密闭容器中,充分反应后放出QkJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 过量NaOH滴入NH4HCO3稀溶液中:NH4++OH-═NH3•H2O | |
| D. | 铜片加入稀HNO3中:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结构简式为:CH3COOH | B. | 乙酸又称为醋酸 | ||
| C. | 可与金属Na反应生成H2 | D. | 分子中原子之间只存在单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
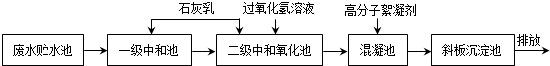
| 离子 | H+ | Cl- | Fe2+ | Fe3+ |
| 浓度(mol/L) | 0.16 | 0.94 | 0.12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com