
| A、反应中氧化剂与还原剂物质的量之比为1:2 |
| B、要使8.7g MnO2完全反应,需投入含0.4molHCl的浓盐酸 |
| C、每生成标准状况下2.24L Cl2,就有7.3gHCl被氧化 |
| D、若有0.4molHCl被氧化,反应中转移的电子数为0.4×6.02×1023个 |
| V |
| Vm |
| 8.7g |
| 87g/mol |
| 2.24L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、加压可使该反应的反应速率变大 |
| B、该反应中反应物的总能量比生成物的总能量高 |
| C、将1molN2和3molH2混合进行反应,反应完成时放出的热量为92kJ |
| D、单位时间内生成1molN2,同时消耗3molH2说明该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、c(H+)和c(OH-)的乘积 | ||
| D、OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO>Cl2>Fe3+>Cu2+>Fe2+ |
| B、Cl2>HClO>Fe3+>Cu2+>Fe2+ |
| C、Cl2>Fe3+>HClO>Cu2+>Fe2+ |
| D、HClO>Cl2>Cu2+>Fe3+>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、平衡常数表达式为K=
| ||
| B、增大体系压强,平衡常数K不发生变化 | ||
| C、升高体系温度,平衡常数K减小 | ||
| D、增加C(s)的量,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入一定量的CaCl2 |
| B、加入一定量的CaCO3 |
| C、加入15mL0.5mol/L的盐酸 |
| D、加入5mLH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制备Al2O3:将AlCl3溶液蒸干灼烧 |
| B、制备Fe(OH)3胶体:向沸水中滴加几滴FeCl3饱和溶液继续加热至红褐色 |
| C、检验溶液中是否含有CO32-:向某溶液中加入稀H2SO4,将产生的气体通入澄清石灰水 |
| D、比较CH3COO-和CO32-结合H+的能力强弱:相同温度下,测定浓度分别为0.1mol/L的Na2CO3和CH3COONa溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
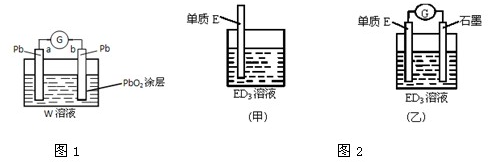
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com