
A、平衡常数表达式为K=
| ||
| B、增大体系压强,平衡常数K不发生变化 | ||
| C、升高体系温度,平衡常数K减小 | ||
| D、增加C(s)的量,平衡正向移动 |


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
| A、Mg2+、Na+、Cl-、CO32- |
| B、Ca2+、HCO3-、Na+、Cl- |
| C、Fe3+、K+、OH-、SCN- |
| D、Cu2+、NH4+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 298k |
| 1073k |
| 1 |
| 2 |
| 873k |
| A、0.25 mol |
| B、0.5 mol |
| C、1 mol |
| D、2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量的氨水 Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
| C、钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| D、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
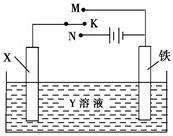
| A、若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法 |
| B、若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀 |
| C、若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D、若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中氧化剂与还原剂物质的量之比为1:2 |
| B、要使8.7g MnO2完全反应,需投入含0.4molHCl的浓盐酸 |
| C、每生成标准状况下2.24L Cl2,就有7.3gHCl被氧化 |
| D、若有0.4molHCl被氧化,反应中转移的电子数为0.4×6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com