
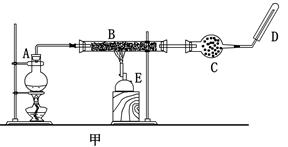
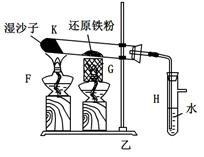
 Fe3O4+4H2
Fe3O4+4H2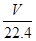 ×
×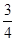 ×56×
×56×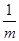 ×100%(1分)(注:化简后且正确的代数式均可,如
×100%(1分)(注:化简后且正确的代数式均可,如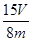 ×100% 或
×100% 或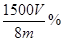 )
) Fe3O4+4H2。
Fe3O4+4H2。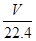 mol,所以根据反应式3Fe+4H2O
mol,所以根据反应式3Fe+4H2O Fe3O4+4H2可知,参加反应的铁的物质的量是
Fe3O4+4H2可知,参加反应的铁的物质的量是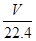 ×
×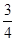 mol,其质量是
mol,其质量是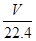 ×
×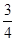 mol×56g/mol,所以铁粉的转化率为
mol×56g/mol,所以铁粉的转化率为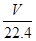 ×
×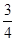 ×56×
×56×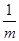 ×100%。
×100%。

科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原混合物中n(Fe)∶n(Fe2O3)=3∶1 |
| B.反应后溶液中Fe2+和Fe3+的物质的量之比为3∶1 |
| C.实际参加反应HCl的物质的量为0.08mol |
| D.向溶液中滴入KSCN溶液,显红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe2O3 | B.Fe3O4 | C.Fe5O7 | D.Fe4O5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。 还原成Mn2+。
还原成Mn2+。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com