
铜及其化合物在生产生活中有着广泛的应用,铜在化合物中的常见化合价有+1、+2。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:__________________________________。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式___________________________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:
Cu+H2SO4 ________________________________________________。
________________________________________________。
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,其理由可能是____(填字母)。
a. Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
【知识点】铜及其化合物的性质C3 B3
【答案解析】 (1)S 1.2NA
(2)2Cu2++4H++O2 2Cu2++2H2O
2Cu2++2H2O
2Cu2++2Cl-+SO32-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
(3)①CuO+SO2↑+H2O ②ac
解析:(1)Cu2S+O2 2Cu+SO2反应制取粗铜,硫元素的化合价从-2升到+4,被氧化,反应中被氧化的元素是S,当消耗32 g Cu2S时,转移电子数目是
2Cu+SO2反应制取粗铜,硫元素的化合价从-2升到+4,被氧化,反应中被氧化的元素是S,当消耗32 g Cu2S时,转移电子数目是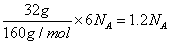 。
。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:2Cu2++4H++O2 2Cu2++2H2O。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,离子方程式:2Cu2++2Cl-+SO32-+H2O
2Cu2++2H2O。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,离子方程式:2Cu2++2Cl-+SO32-+H2O 2CuCl↓+SO42-+2H+。
2CuCl↓+SO42-+2H+。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①按照甲同学猜想:铜被氧化得CuO,硫酸还原为SO2,化学方程式表示为:
Cu+H2SO4 CuO+SO2↑+H2O,
CuO+SO2↑+H2O,
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,分析可能的理由时,应该从反应现象和氧化还原反应原理入手,ac符合。
【思路点拨】本题考查了铜及其化合物的性质,注意题目的引导,结合所学知识、原理即可解答。


科目:高中化学 来源: 题型:
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
 某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后数对表示对应的坐标):
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后数对表示对应的坐标):
回答下列问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是________(填序号)。
a.0~1 min b.1~3 min c.3~8 min d.8~11 min
(2)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是________________,曲线Ⅱ改变的条件可能是________________。
(3)下列表述能表示该反应已达平衡的是________(填序号)。
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体的平均摩尔质量不再改变 d.容器内各物质的物质的量相等
d.容器内各物质的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3、 CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断不正确的是
A.加人KSCN溶液一定不变红色 B.溶液中一定含Fe2+
C.溶液中一定不含Cu2+ D.剩余固体中一定含Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L; W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径: W>Z>Y>X>M B.XZ2、X2M2、W2Z2均为直线形的共价化合物
C.由X元素形成的单质不一定是导体
D.由 X、Y、Z、M四种元素形成的化合物一定既含有离子键,又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 mol·L-1KNO3溶液:H+、Fe2+、SCN-、SO42-
B. 的溶液:K+、Ba2+、NO3-、Cl-
的溶液:K+、Ba2+、NO3-、Cl-
C.pH=0的溶液:Al3+、Cl-、SO42-、CO32-
D.c(ClO-) = 1.0 mol·L-1的溶液:Na+、I-、S2-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素Q、W、X、Y、Z的原子序数依次增大,X元素的颜色反应呈黄色,Q原子的最外层电子数是其内层电子数的2倍,W、Z原子的最外层电子数相同,Z元素的核电荷数是W的2倍,Y是地壳中含量最多的金属元素。下列说法不正确的是 ( )
A.工业上常用电解的方法制备X、Y的单质
B.元素Q和Z能形成QZ2型的共价化合物
C.原子半径的大小顺序:r(X)> r(Y)> r(W)> r(Q)
D.元素X、Y的最高价氧化物对应的水化物之间能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
参考下表键能数据,估算晶体硅在氧气中燃烧生成二氧化硅晶体的热化学方程式:Si(s)+O2(g)=SiO2(s)中,ΔH的值为
| 化学键 | Si—O | O==O | Si—Si | Si—Cl | Si—C |
| 键能kJ·mol-1 | 460 | 498.8 | 176 | 360 | 347 |
A.-989.2 kJ·mol-1 B.+ 989.2 kJ·mol-1
C.-61.2 kJ·mol-1 D.-245.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B.pH =11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)> c(OH-)>c(H+)
C.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH) = 0.1 mol·L-1
D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性 c(CH3COO-)>c(Cl-)
>c(CH3COOH)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com