
FeCl3、 CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断不正确的是
A.加人KSCN溶液一定不变红色 B.溶液中一定含Fe2+
C.溶液中一定不含Cu2+ D.剩余固体中一定含Cu
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
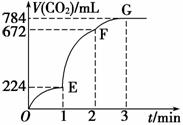 用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是
用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是
A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.04 mol·L-1·min-1
C.OE、EF、FG三段中,该反应用二氧化碳 表示的平均反应速率之比为2∶6∶7
表示的平均反应速率之比为2∶6∶7
D.F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学一选修3:物质结构与性质】(15分)
碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关。
(1)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,理由是 。
(2)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态碳原子的电子排布图 ,该物质的K原子和C60分子的个数比为 。
(3)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
(4)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂。
①写出CO的一种常见等电子体分子的结构式 ;两者相比较沸点高的为
(填分子式)。
②Fe(CO)5在一定条件下发生反应:Fe(CO)5(s)=Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的化学键类型为 。
(5)NiXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个Ni原子之间的最短距离为___________m(精确至0.01)。若晶体中的Ni分别为Ni2﹢、Ni3﹢,此晶体中Ni2﹢与Ni3﹢的最简整数比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列①~⑩中选出适宜的词语填入下列每小题的空格中(填编号):
①渗析 ②盐析 ③聚沉 ④溶胶 ⑤凝胶 ⑥布朗运动 ⑦电泳
⑧丁达尔现象 ⑨中和 ⑩水解
(1)肥皂水中透过强光,可以见到光亮的“通路”。这种现象称为___________。
(2)在制取肥皂时,加入食盐细粒使肥皂析出,这个过程称为_____________。
(3)在肥皂水中滴加酚酞,溶液变成红色,说明高级脂肪酸根离子发生了____________。
(4)在氢氧化铁胶体中加入浓硫酸铵溶液,产生红褐色沉淀,这种现象叫做___________。
(5)用半透膜把制取的氢氧化铁胶体中含有的NaCl分离出来的方法叫做___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与H2O
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
A.①③⑥⑧ B.③⑦⑧ C②⑤⑥⑦ D.①④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列事实所列出的相应结论正确的是
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| D | 常温下白磷可自燃,而氮气须在放电时才与氧 气反应 | 非金属性:P>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
铜及其化合物在生产生活中有着广泛的应用,铜在化合物中的常见化合价有+1、+2。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:__________________________________。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式___________________________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:
Cu+H2SO4 ________________________________________________。
________________________________________________。
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,其理由可能是____(填字母)。
a. Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
查看答案和解析>>
科目:高中化学 来源: 题型:
2SO2(g)+O2(g)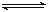 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
| n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
| 含硫反应物的平衡转化率% | 80 |
|
|
|
下列判断中,正确的是
A.乙中SO3的平衡转化率为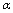 1=20% B.平衡时,丙中c(SO3)是甲中的2倍
1=20% B.平衡时,丙中c(SO3)是甲中的2倍
C.平衡时,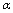 3<
3<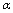 1 D.该温度下,平衡常数的值为400
1 D.该温度下,平衡常数的值为400
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com