
【题目】氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是
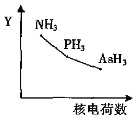
A. 相对分子质量B. 稳定性C. 沸点D. R-H键长
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是
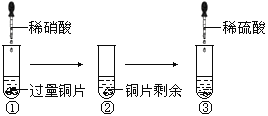
A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeSO4·7H2O ![]() Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
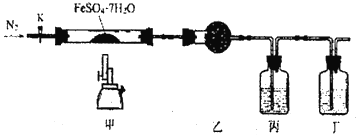
A. 乙、丙、丁中可依改盛装无水CuSO4、Ba(NO3)2溶液、品红溶液
B. 实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下转化关系(其他产物及反应所需条件均已略去)。
![]()
以下推断错误的是
A.当X是盐酸时,则F可能是稀硫酸
B.当X是氢氧化钠时,则D是红棕色气体
C.当X是不论是盐酸还是氢氧化钠时,则F都可能是强酸
D.当X是氢氧化钠时,B跟Cl2反应可能有白烟现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有3.5 mol KNO3和2.2 mol H2SO4,向其中加入1.2 mol Fe,充分反应(已知NO![]() 被还原为NO)。下列说法正确的是
被还原为NO)。下列说法正确的是
A.反应过程中转移的电子数3NA
B.反应后生成NO的体积为24.64 L
C.所得溶液中c(Fe2+)∶c(Fe3+)=1∶3
D.所得溶液中c(NO3-)=2.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态Ni2+的价层电子轨道表达式为________,C、N、O的第一电离能从小到大的顺序为________。
(2)N、P可形成一些复杂离子,如(CH3)3NH+、NO2+、PCl6-等。
①(CH3)3NH+ 中N原子的杂化类型为___,NO2+的空间构型为______________。
②PCl5是一种白色固体,在加压下于148℃时液化,形成一种能导电的熔体。熔体能导电的原因是___________。
(3)Fe、Ni易与CO形成配合物,Fe(CO)5中σ键与π键个数比为______,Ni(CO)4熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,Ni(CO)4为______晶体。
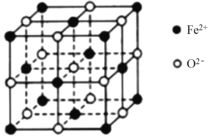
(4)FeO、NiO的晶体类型与结构和NaCl相同。
① 熔点FeO_____NiO(填“>”、“<”或“=”)。
② FeO 晶胞如下图,Fe2+的配位数为_______。
③ FeO在氧气中加热,部分Fe2+被氧化为Fe3+,晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为a cm,密度为g·cm-3,则x=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X可能含有Na+、Fe3+、Ca2+、SO42-、 CO32- 、Cl-、I-中的几种离子。为确定其组成,设计并完成以下实验:

根据上述实验,以下推测合理的是
A. 溶液X中是否存在Na+还需要通过焰色反应进一步确认
B. 溶液X中一定不含Fe3+、Ca2+、SO42-
C. 为确定溶液X中是否含有Cl-,可取溶液2加入CCl4充分萃取后,再取上层液体加入AgNO3溶液
D. 溶液X的溶质为Na2CO3和NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:______.
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(2)若假设1成立,则实验现象是______.
(3)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?______.简述你的理由______.
(4)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明假设______成立
(5)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫单质及其化合物性质是一个重要的课题。回答下列问题:
(1)恒容密闭容器中,工业固氮:N2(g)+3H2(g) ![]() 2NH3(g)的平衡常数K值和温度关系如表:
2NH3(g)的平衡常数K值和温度关系如表:
温度/℃ | 25 | 200 | 300 | 400 | 450 |
K | 5108 | 1.0 | 0.86 | 0.507 | 0.152 |
①从上表列出数据分析,该反应为__________反应(填:“吸热”或“放热”)。
②有关工业合成氨的研究成果,曾于1918年、1931年、2007年三次荣膺诺贝尔奖。下列关于关于合成氨反应描述的图像中,不正确的是_________(填:字母选项)。
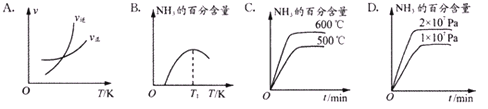
③450℃时,测得某时刻氨气、氮气、氢气物质的量浓度分别为3mol/L、2mol/L、1mol/L时,该反应的v(正)____________v(逆)(填“>”、“=”或“<”)。
(2)近年,科学家又提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)
2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
(3)联氨(N2H4)、二氧化氮(NO2)可与KOH溶液构成碱性燃料电池,其电池反应原理为2N2H4 +2NO2 = 3N2+8H2O。则负极的电极反应式为__________________________。
(4)部分金属硫化物的溶度积常数(Ksp)如下表:
硫化物 | CuS | ZnS | MnS | FeS |
Ksp | 6.3×10-36 | 2.9×10-25 | 2.5×10-13 | 6.3×10-18 |
由列表数据分析推知,向含有Cu2+、Zn2+、Mn2+、Fe2+的工业废水中加入MnS粉末的作用是_____________________________________。
(5)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com