
| A. | 原子及其简单阴离子的核外电子层数都等于该元素所在的周期数 | |
| B. | 原子最外层电子数都等于其所在的族序数 | |
| C. | 元素周期表从ⅢB到ⅡB族共8个纵行,全都是金属元素 | |
| D. | 同周期表中ⅦA族元素的原子半径较小 |
分析 A.原子形成简单阴离子,电子层不变,电子层等于周期数;
B.主族元素原子的最外层电子数=族序数;
C.元素周期表中从ⅢB到ⅡB这8个纵行的元素属于过渡金属元素;
D.同周期元素从左到右原子半径逐渐减小.
解答 解:A.原子形成简单阴离子,电子层不变,电子层等于周期数,故A正确;
B.主族元素原子的最外层电子数=族序数,如Na最外层有1个电子,则族序数为1,即主族元素原子的最外层电子数等于其所在族的族序数,但0族不一定符合,如He最外层电子数为2,故B错误;
C.元素周期表中从ⅢB到ⅡB这8个纵行的元素为过渡金属元素,都为金属元素,故C正确;
D.同周期元素从左到右原子半径逐渐减小,所以ⅦA族元素的原子半径较小,故D正确.
故选B.
点评 本题考查元素周期表的结构及元素在周期表中的位置,为高频考点,熟悉元素的位置及原子结构的关系、同周期元素的变化规律即可解答,难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{{{{10}^{-8}}+{{10}^{-10}}}}{2}mol/L$ | B. | $\frac{{{{10}^{-6}}+{{10}^{-4}}}}{2}mol/L$ | ||
| C. | (10-8+10-10)mol/L | D. | 2×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(NO3)2溶液可作电解质溶液 | |
| B. | 在电解质溶液中,电子由负极流向正极 | |
| C. | 锌极的质量先减小后增大 | |
| D. | 可用镁作正极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
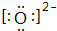 ;
;| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com