
【题目】已知某反应A(g)+B(g)C(g)+D(g) 过程中的能量变化如图所示,回答下列问题.
(1)该反应是反应(填“吸热”、“放热”),该反应的△H=KJmol﹣1(用含E1、E2的代数式表示),1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量(填“一定高”、“一定低”、“高低不一定”).
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1 , E2 , △H(填“增大”、“减小”或“不变”).
【答案】
(1)吸热;E1﹣E2;一定低
(2)减小;减小;不变
【解析】解:(1)由图象可知该反应是一个能量升高的反应,所以属于吸热反应;△H=反应物的总键能﹣生成物的总键能,所以△H=E1﹣E2;由图象可知可知该反应是一个能量升高的反应,所以1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量低,故答案为:吸热; E1﹣E2;一定低;(2)加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2的变化是减小,催化剂不改变反应物总能量与生成物总能量之差即反应热不变,所以E的大小对该反应的反应热无影响;故答案为:减小;减小;不变.
(1)根据反应物与生成物总能量大小判断,根据△H=反应物的总键能﹣生成物的总键能;(2)加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变.


科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各叙述正确的是
A. 3 mol OH-的质量为 51 g/mol B. 铁的摩尔质量等于它的相对原子质量
C. 一个 12C 的实际质量约等于 12/6.02×1023 g D. 二氧化碳的摩尔质量是 44 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对加快反应速率有明显效果的是( )
A. Na与水反应时,增加水的用量
B. Al与稀硫酸反应制取H2时,改用浓硫酸
C. Na2SO4与BaCl2两种溶液反应时,增大压强
D. 大理石和盐酸反应制取CO2时,将块状大理石改为粉末状
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应N2+3H2=2NH3的能量变化如图所示,
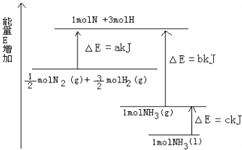
(1)1mol N 和3mol H 生成1mol NH3(g)是_________________能量的过程(填“吸收”或“释放”)。
(2)![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g); △H=_____;
H2(g)=NH3(g); △H=_____;
(3)N2(g)和H2生成NH3(1)的热化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极. 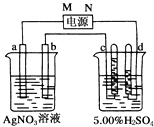
通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体.回答:
(1)直流电源中,M为极.
(2)Pt电极上生成的物质是 , 其质量为g.
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2::: .
(4)AgNO3溶液的浓度(填“增大”“减小”或“不变”.下同) , H2SO4溶液的浓度 .
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向相同容积的甲乙两容器中都分别充入1molSO2和0.5molO2,若甲容器保持温度容积不变,乙容器保持温度压强不变,分别达到平衡,下列说法正确的是
A. 平衡时,容器内的压强:甲>乙 B. 反应达到平衡时所需时间:甲<乙
C. 平衡时,氧气的浓度:甲<乙 D. 平衡时,容器内SO3的体积百分数:甲>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com