
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
【答案】D
【解析】A、燃烧热为1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,生成的H2O为液态水,热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1,故A错误;B、合成氨是可逆反应,不能完全进行到底,题目中没有说明转化的氮气或氢气的物质的量,因此无法计算放出的热量,故B错误;C、发生反应是Ca(OH)2+H2SO4=CaSO4+2H2O,存在Ca2+和SO42-的反应,因此放出的热量不是2×57.3kJ,故C错误;D、2g氢气完全燃烧生成液态水,放出285.8kJ·mol-1,即消耗2mol氢气完全燃烧放出的热量为2×285.8kJ=571.6kJ,氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,故D正确。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是
A. 少量Na2SO4固体,v(H2)减小 B. VmLBaCl2溶液,v(H2)不变
C. 加入细小的碳粒,v(H2)增大 D. 加入NH4HSO4固体,v(H2)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )

A. A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3和NaHCO3
B. B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3-
C. B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL
D. 原NaOH溶液的物质的量浓度为1.0mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示:另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示。则下列分析正确的是( )

A. 图1中,a到b的过程中有0.01 mol电子发生了转移
B. 图1整个过程中共生成0.26 g水
C. 图2三条曲线中,表示CuO和其所含Cu元素质量关系的曲线是A
D. 图1中A和B化学式分别为Cu2O和CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Al2(SO4)3和Na2SO4的混合溶液中,已知c(Al3+):c(Na+)=1:2,若c(SO42-)=2.5molL-1,则c(Al3+)为( )
A. 0.5molL-1 B. lmolL-1 C. 2molL-1 D. 3molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用2-氯丙烷制取少量的1,2-丙二醇,经过下列哪几步反应 ( )
A.加成→消去→取代B.消去→加成→水解
C.取代→消去→加成D.消去→加成→消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华传统文化中蕴含着诸多化学知识,下列说法正确的是( )
A. “杨花榆荚无才思”中的“榆荚”主要成分为蛋白质
B. “霾尘积聚难见人”,雾和霾是气溶胶,具有丁达尔效应
C. “日照香炉生紫烟”中的紫烟指“碘的升华”
D. “火树银花不夜天”指的是金属单质的焰色反应,属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol/L浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
Ⅱ | 将I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol/L稀盐酸混合物 | 无明显现象 |
① I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是________。
② Ⅱ中发生了分解反应,反应的化学方程式是________。
③ Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:
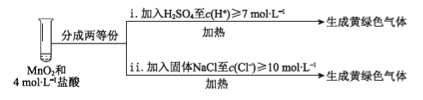
将实验Ⅲ、Ⅳ作对比,得出的结论是________;将实验现象Ⅳ中的ⅰ、ⅱ作对比,得出的结论是_______。
(2)研究盐酸能否被氧化性酸氧化。
① 烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸____(填“能”或“不能”)氧化盐酸。
② 向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | 试纸先变蓝,不褪色 |
通过实验I、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com