
【题目】物质的量浓度相同的下列溶液中,c(NH4+)最大的是
A. NH4Cl B. CH3COONH4 C. NH4HCO3 D. NH4HSO4
【答案】D
【解析】
根据铵根离子的浓度和水解的影响角度来分析,若含有对铵根离子水解起促进作用的离子,则铵根离子水解程度增大,溶液中的c(NH4+)减小,反之,若含有抑制铵根离子水解的离子,则铵根的水解程度减弱,溶液中的c(NH4+)增大,据此分析判断。
物质的量浓度相同的下列溶液中不考虑(水解)其他因素影响,则ABCD选项中铵根离子浓度分别比为1:1:1:1,其水解方程式为:NH4+ + H2O![]() NH3·H2O + H+,
NH3·H2O + H+,
A. NH4Cl溶液中,NH4+的水解不受氯离子的影响;
B. CH3COONH4溶液中醋酸根离子对NH4+的水解起到促进作用,导致NH4+水解程度大,其溶液中的铵根离子浓度c(NH4+)减小;
C. NH4HCO3溶液中HCO3-对NH4+的水解起到促进作用,导致NH4+水解程度大,其溶液中的铵根离子浓度c(NH4+)减小;
D. NH4HSO4溶液中H+对NH4+的水解起抑制作用,导致NH4+水解程度很小,溶液中的c(NH4+)增大;
综上所述,NH4+的浓度最大的是NH4HSO4,故D项正确,
答案选D。


科目:高中化学 来源: 题型:
【题目】Na2S2O5是常用的防腐剂和漂白剂。可利用烟道气中的SO2生产Na2S2O5,其流程如下:
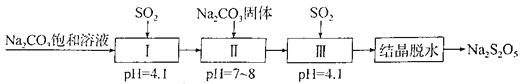
下列说法正确的是
A. 上述制备过程所涉及的物质中只有一种酸性氧化物
B. Na2S2O5作防腐剂和SO2作漂白剂时,均表现还原性
C. 上述流程中的Na2CO3饱和溶液和Na2CO3固体不可互换
D. 实验室模拟“结晶脱水”时用到的仪器只有蒸发皿、玻璃棒、烧杯、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,I的原子序数是W的两倍,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________,Y的电子排布图为_________________________
(2)化合物ZX3中Z原子的杂化方式为___________,ZW2- 离子的立体构型是___________;
(3)①Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
②W与I的简单氢化物中W的熔沸点更高,原因是______________________
(4)向Q元素的硫酸盐溶液中通入足量ZX3,充分反应后溶液呈深蓝色,该反应的离子方程式为__________________________________________________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下列实验装置进行氯气的性质实验。玻璃管内装有分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是()

① | ② | ③ | ④ | |
A | 白色 | 先变红色后无色 | 橙色 | 蓝色 |
B | 无色 | 红色 | 橙色 | 紫色 |
C | 无色 | 白色 | 橙色 | 蓝色 |
D | 白色 | 无色 | 无色 | 紫色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为________________。
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:

图1
实验过程中应将温度控制在________________。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为________________。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是________________。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图2所示。A包含物质的化学式为N2和________________。


图2 图3
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为________________。
②C点高于B点的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:
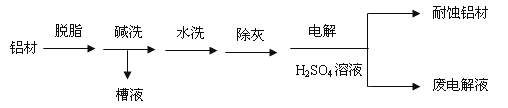
①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3b.CO2c.NaOH d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.
(1)以下是工业上合成甲醇的反应:![]()
![]()
![]()
下表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 |
|
|
|
K |
|
|
|
由表中数据判断反应I为 ______ 热反应(填“吸”或“放”).某温度下,将2molCO和6mol![]() 充入2L的密闭容器中,充分反应,达到平衡后,测得
充入2L的密闭容器中,充分反应,达到平衡后,测得![]() ,则CO的转化率为 ______ ,此时的温度为 ______(从表中选择).
,则CO的转化率为 ______ ,此时的温度为 ______(从表中选择).
(2)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有![]() 时,实验室利用如图装置模拟该法:
时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ______ .
②请完成电解池中![]() 转化为
转化为![]() 的离子反应方程式:______
的离子反应方程式:______![]() +______
+______ ![]() ______ = ______
______ = ______ ![]() +______
+______![]() ______
______
(3)处理废水时,最后![]() 以
以![]() 形式除去,当
形式除去,当![]() 时,
时,![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() ______.(已知,
______.(已知,![]() ,
,![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com