
【题目】某同学实验探究氨气的还原性并进行系列实验。
(1)将光亮的紫红色铜丝绕几圈后,在酒精灯火焰上加热,等铜丝变黑后,趁热将铜丝插入疏松的氯化铵晶体里,即刻发现有白色烟雾生成,拿出铜丝后,铜丝又转变为光亮的紫红色。在焊接铜器时用氯化铵除去铜器表面的氧化铜即利用了该原理,请完成该反应:
![]()
(2)利用下列装置,进行与金属氧化物MxOy反应生成M、H2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
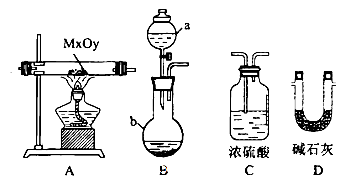
①仪器a的名称为__________,仪器b中装人的试剂可以是____________.
②按气流方向正确的装置连接顺序为(填序号,装置可重复使用):___________。
③实验结束时,应首先__________(填序号)。
I.熄灭A装置的酒精灯
II.停止从a中滴加液体
④若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为__________ (用含X、y、m、n的式子表示)。
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶液没发生明显变化。推测该固体成分可能是(将化学式填人下表,你认为有几种可能填几种)。
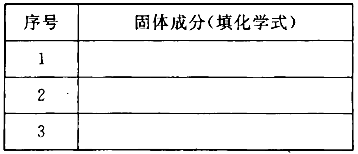
【答案】(1)4CuO + 2NH4Cl=3Cu +CuCl2+ 4H2O(2)①分液漏斗,,氢氧化钠或碱石灰;②BDADC;③实验结束时,应首先停止从a中滴加液体,没有必要制备多余的氨气;④(18m-16n)y/nx (3)铁铁或者是铁和三氧化二铁
【解析】
试题分析:(1)根据化合价升降法进行配平,可得4CuO + 2NH4Cl=3Cu +CuCl2+ 4H2O
(2)①根据仪器的特征,仪器a的名称为分液漏斗,仪器b中装入的试剂可以是氢氧化钠或碱石灰,通过吸收水有利于制备出氨气。
②从发生装置中出来的氨气带有水份,必须要进行干燥,所以B接D,D接A,吸收反应生成的水要用D装置,最后空气中的水不能进入到D中,还要用到C,因此,按气流方向正确的装置连接顺序为BDADC。③实验结束时,应首先停止从a中滴加液体,没有必要制备多余的氨气。
④根据氧元素守恒,MxOy—— yH2O,已知金属氧化物的质量为mg,生成水的质量为ng,则m:n=(xM+16y):18y,求得M的相对原子质量为(18m-16n)y/nx。
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶液没发生明显变化。说明溶液中没有三价铁离子,因为Fe+2Fe3+= 3Fe2+,所以反应后的固体成分可能全是铁,或者是铁和三氧化二铁。


科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。如:CH3-CH=CH-CH3可简写为![]() 某有机物X的键线式为
某有机物X的键线式为![]()
(1)X与足量的H2在一定条件下反应可得到有机物Y,则Y分子的一氯取代产物有_________种。
(2)X属于(填下列选项代码)______________。
A.芳香烃 B.环烃 C.不饱和烃 D.炔烃
(3)X的同分异构体Z属于芳香烃,能使溴水褪色,Z的结构简式为_______________,该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程式_________________。
(4)某醇W与X的相对分子质量相同,1mol W与足量Na反应能产生标准状况下的氢气22.4 L,经测定W分子有如下特点:①一个碳原子最多连接一个官能团;②该分子不存在官能团位置异构现象。则W的结构简式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述正确的是( )

A.分子中的官能团有羟基、碳碳双键、醚键、酯基
B.若R为乙基则该物质的分子式可以表示为C16H14O7
C.lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol
D.lmol该化合物最多可与7mol Br2完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的许多金属能形成配合物。科学家通过X射线测得胆矾结构示意图可简单表示如下: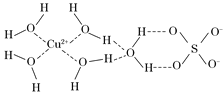
(1)Cu基态原子的外围电子排布为 ,Cr基态原子的外围电子排布为 ,这样排布的理由是_____________________。
(2)NH3是一种很好的配体,原因是______________________。
(3)图中虚线表示的作用力为________________。
(4)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在该晶体中,含有的原子团或分子有:[Cu(NH3)4]2+、NH3、SO42-、H2O,其中[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团或分子是__________,写出一种与此正四面体结构互为等电子体的分子的分子式 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。Ni(CO)4易溶于________(填标号)。
A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高经济效益,而且能够防止环境污染,现按以下方式进行处理利用:
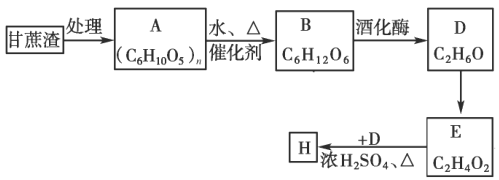
试回答:
(1)A的名称是____________;
(2)写出D的同分异构体的结构简式____________。
(3)D到E的反应类型为____________,D到E的反应试剂可以为____________。
(4)实验室制备H后,提纯H的分离方法为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,六种元素价电子数之和为26,原子半径依Y、Z、M、N、Q、X依次减小。依据信息,回答下列问题:
(1)Q的核外电子排布图为 。
(2)除X外,其余元素的第一电离能由小到大的顺序为 (用元素符号作答)。
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,组成中含M元素的质量分数为73.7%,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体。写出A的电子式 ,常温下A与水反应的化学方程式为 。
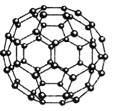
(4)Z元素形成的另一种分子晶体结构如图所示,Z60分子是由60个Z原子构成的,形状酷似足球,有32个面,其中12个面为正五边形,20个面为正六形。Z60分子可与Q元素形成的单质Q2发生加成反应,则加成产物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备溴苯的实验装置如右图所示,请回答下列问题:
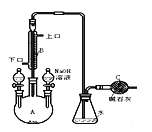
(1)反应开始前已向仪器A中加入的固体药品是铁粉,则装在左侧分液漏斗中的液体药品是 。
(2)写出实验室制溴苯的化学方程式 。
(3)该反应装置中冷凝管B有上、下两个口,冷却水应从 口进入(填“上”或“下”)。
(4)右侧分液漏斗中的物质在 加入A中(填“反应前”、“反应中”或“反应后”),用离子方程式表示其作用是 。
(5)C中碱石灰的作用是 。
(6)该过程可以如下表述:3Br2+2Fe=2FeBr3 ; Br2+FeBr3=FeBr4-+Br+ (不稳定) ;
![]() +Br+→[
+Br+→[![]() ] ; [
] ; [![]() ]+FeBr4-→
]+FeBr4-→![]() +HBr+FeBr3 。
+HBr+FeBr3 。
由上述反应可推知:![]() +Br2 →
+Br2 → ![]() +HBr 中的催化剂为 。(填字母)
+HBr 中的催化剂为 。(填字母)
A. Br2 B.FeBr3 C.Br+ D.FeBr4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
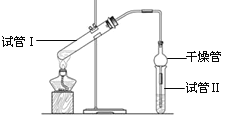
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: 。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
① 实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
② 分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]辉铜矿主要成分为Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质。研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
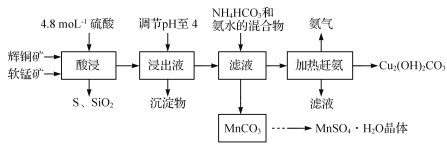
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制250 mL 4.8 mol·L1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要 。
(2)酸浸时,为了提高浸取率可采取的措施有 (任写一点)。得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式: 。
(3)调节浸出液pH=4的作用是 。
(4)本工艺中可循环使用的物质是 (写化学式)。
(5)获得的MnSO4·H2O晶体需要进一步洗涤、干燥,洗涤时应用 洗涤。
(6)测定MnSO4·H2O样品的纯度:准确称取样品14.00 g,加蒸馏水配成100 mL溶液,从中取出25.00 mL用标准的BaCl2溶液测定,完全反应后得到了4.66 g沉淀,则此样品的纯度为__________(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com