
����Ŀ���л���Ľṹ���á�����ʽ����ʾ���磺CH3��CH��CH��CH3�ɼ�дΪ![]() ij�л���X�ļ���ʽΪ
ij�л���X�ļ���ʽΪ![]()
��1��X��������H2��һ�������·�Ӧ�ɵõ��л���Y����Y���ӵ�һ��ȡ��������_________�֡�
��2��X���ڣ�������ѡ����룩______________��
A�������� B������ C���������� D��Ȳ��
��3��X��ͬ���칹��Z���ڷ���������ʹ��ˮ��ɫ��Z�Ľṹ��ʽΪ_______________���÷�����Z��һ�������¿ɷ����ۺϷ�Ӧ��д���䷴Ӧ�Ļ�ѧ����ʽ_________________��
��4��ij��W��X����Է���������ͬ��1mol W������Na��Ӧ�ܲ�����״���µ�����22.4 L�����ⶨW�����������ص㣺��һ��̼ԭ���������һ�������ţ��ڸ÷��Ӳ����ڹ�����λ���칹������W�Ľṹ��ʽΪ___________________��
���𰸡���1��2 ��2��BC��3��![]() ��
��![]()
��4��![]()
��������
�����������1���л���X�ļ���ʽΪ![]() ��X��������������һ�������·�Ӧ�õ��л���Y����Y�ṹ��ʽΪ
��X��������������һ�������·�Ӧ�õ��л���Y����Y�ṹ��ʽΪ![]() ��YΪ���ĶԳƣ����Ҿ���Գƣ����Խ���һ�֣���Y���ͽ����һ�֣������������͵���ԭ�ӣ�����Y��һ�ȴ�����2�֡�
��YΪ���ĶԳƣ����Ҿ���Գƣ����Խ���һ�֣���Y���ͽ����һ�֣������������͵���ԭ�ӣ�����Y��һ�ȴ�����2�֡�
��2������X�ļ���ʽ��֪���÷��Ӻ���̼̼˫�������ڲ����������л������ڻ�������ѡBC��
��3��X�IJ����Ͷ�Ϊ5��X��ͬ���칹��Z���ڷ�������˵�����б���������ʹ��ˮ��ɫ��˵������̼̼˫������Z�Ľṹ��ʽΪ![]() ��
��![]() �����к���˫�����ܷ����ۺϷ�Ӧ��
�����к���˫�����ܷ����ۺϷ�Ӧ��![]() ��
��
��4������X�Ľṹ��ʽ��֪��X�ķ���ʽΪC8H8����Է�������Ϊ108��ij��W��X����Է���������ͬ��ҲΪ108��1mol W������Na��Ӧ�ܲ�����״���µ�����22.4 L��1mol��������˵��1����W����2���ǻ�����ô��ķ���ʽΪCmHnO2����12m+n=108-32=76����һ��̼ԭ���������һ�������ţ��ڸ÷��Ӳ����ڹ�����λ���칹������W�Ľṹ��ʽΪ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.��ȼ������Ҫ�ɷ���CH4��nH2O
B.һ�������£�ú���������ã����Եõ�Һ��ȼ��
C.����֬������Ӧ�����Һ�м����ȵı���ʳ��ˮ����������ձ��ײ���������
D.ʯ�ʹ��ѻ����ѽⶼ������ʯ�ͼӹ�����Ҫ�ֶΣ������ڻ�ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�����������������������������Ѿ���ʼ��������/�綯��϶��������ϡ������طŵ�ʱ�ĵ缫��ӦΪ:H2+2OH--2e-=2H2O��NiO(OH)+H2O+e-=Ni(OH)2+OH-������˵����ȷ����
A.��طŵ�ʱ��H2������ԭ��ӦB.��طŵ�ʱ��Ni(OH)2����������Ӧ
C.��س��ʱ��H2O������ԭ��Ӧ.D.��س��ʱ��NiO(OH)������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��A����Է�������Ϊ140������̼����������Ϊ0��857��A������������̼ԭ�Ӳ�����ֱ��������A��һ������������ֻ����G��G��ʹʯ����Һ��졣
��֪��![]() ��д����
�����
��1��A�ķ���ʽ�� ��
��2��������A��G�Ľṹ��ʽ��A ��G
��3����Gͬ���ͬ���칹�壨��G�������� �֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ����, ��Ա��е���������Ԫ��,��д���пհף���������˵������Ԫ�ط��š���ѧʽ�Ȼ�ѧ���
���� | IA | ��A | IIIA | ��A | ��A | ��A | ��A | 0�� |
1 | �� | |||||||
2 | �� | �� | �� | �� | �� | |||
3 | �� | �� | �� | |||||
4 | �� |
��1������ЩԪ���У���ѧ��������õ��� ��Ԫ��ԭ�Ӱ뾶��С���� ������Ϊ���������������� ������Ϊ�뵼����ϵ��� ��������������ǿ��Ԫ���� ��
��2��Ԫ������һ��ͬλ�أ���8�����ӣ��ɲⶨ�������,����ͬλ�صķ����� ��
��3��������Ԫ�ص�����������Ӧˮ�����У�������ǿ�Ļ�����Ļ�ѧʽ�� ��������ǿ�Ļ�����Ļ�ѧʽ�� ��
��4��д��������̬�⻯����������������Ӧˮ���ﷴӦ�ķ���ʽ ��
��5��Ԫ������һ���⻯���ֽܷ�Ϊ������һ���⻯��˷ֽⷴӦ�Ļ�ѧ����ʽ��________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҽ���Ȼ��ƿ������������ơ�������������ҩ��Թ�ҵ̼���(��������Na+��Al3+��Fe3+������)����ҽҩ����ˮ���Ȼ���(CaCl2��2H2O����������Ϊ97.0%~103.0%)����Ҫ�������£�
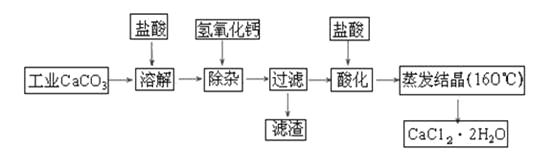
��1�����Ӳ���ʱ�����������ƹ��壬������Һ��pHΪ8.0~8.5���Գ�ȥ��Һ�е�����Al3+��Fe3+������Fe(OH)3�Ƿ������ȫ��ʵ�������_____________________________��
��2���ữ�����Ǽ������ᣬ������Һ��pHԼΪ4.0����Ŀ���У�
��___________________________����___________________________��
��3���ⶨ��Ʒ��Cl-�����ķ����ǣ�
A����ȡ0.7500 g��Ʒ���ܽ⣬��250 mL����ƿ�ж��ݣ�B����ȡ25.00 mL������Һ����ƿ�У�C����0.0500 mol��L-1 AgNO3��Һ�ζ����յ㣬����AgNO3��Һ�����ƽ��ֵΪ20.00 mL��
�������ⶨ�����в���Ҫ��ʢװ��Һ��ϴ�������� ������ϴ��ᵼ�½��
������������Ʒ��CaCl2��2H2O����������Ϊ________________��
���������������ⶨ����Ʒ��CaCl2��2H2O����������ƫ��(�ⶨ�����в��������ɺ���)�������ԭ���У� �� ��
��4����ҵ��ұ�������Ƶķ����� ����д����ұ���Ļ�ѧ��Ӧ����ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1�����ӱ��ӵ��Ҵ���Һ�л��ձ��ӣ������в�����������˳���� ������ĸ����
������ ������ ��������Һ ���������������� ��ͨ�����CO2
����������NaOH ��Һ ����������FeCl3��Һ ����������Ũ��ˮ
A�� �� �� B���� �� �� �� C���ܢ� D���� �� ��
��2������˵����ȷ���� ������ţ���
����ѿ�Ǽ���ˮ�������ܷ���������Ӧ�����Թ��ڱڵ���������ϡ��ˮϴ��
����������Һ�м��뱥���������Һ���г�����������ˮ�����Ҳ���ܽ�
������Һ�м��뼸��ϡ������ȼ����ӣ���ȴ�����������Һ��ˮԡ���ȣ�û�й۲쵽��������֤������δ����ˮ��
��ֻ����ˮ���ܼ������Ȼ�̼���ױ�����ϩ���Ҵ�
����֪��CH3CH2OH+NaBr+H2SO4(Ũ) ![]() CH3CH2Br+NaHSO4 +H2O��
CH3CH2Br+NaHSO4 +H2O��
ʵ�����Ʊ������飨�е�Ϊ38.4������װ����ͼ��Բ����ƿ�м���10mL95���Ҵ���28mLŨ���ᣬȻ�������ϸ��10.3g�廯�ƺͼ������Ƭ��С����ȣ�ʹNaBr��ַ�Ӧ��
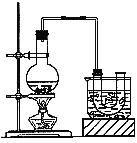
��1����Ӧʱ���¶ȹ����ή���������IJ��ʣ�ԭ���� ��Ҳ�ɿ����к���ɫ���������������Ļ�ѧʽΪ ��Ϊ�����¶ȹ��ߣ��˲��� ���ȡ�
��2����Ӧ������U�ι��д��Ƶ���������ػ�ɫ��Ϊ�˳�ȥ���е����ʣ����ѡ�������Լ��е�
(�����)��
A��Na2SO3��Һ B��H2O C��NaOH��Һ D��CCl4
��3����������NaOHˮ��Һ��NaOH�Ҵ���Һ������ͬ���͵ķ�Ӧ�����ɲ�ͬ�IJ���������ͼ��ʾװ�ý���ʵ������ʵ����Ŀ���� �� ʢˮ���Թܣ�װ�ã��������� ��
��4��Ϊ�����������е���Ԫ�أ���ȷ�IJ���˳���ǣ�ȡ������������Ȼ�� (�����)��
�ټ��� �ڼ���AgNO3��Һ �ۼ���ϡHNO3�ữ �ܼ���NaOH��Һ ����ȴ
��5�����ᴿ���յõ�������������Ϊ7.63g�����������IJ���Ϊ ��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ʒ�ںϳɡ�ҽҩ��Ⱦ�ϵȹ�ҵ���й㷺��;����ṹʽ��ͼ��ʾ������ȩˮ��Һ�백ˮ����������Ƶ�������Ʒ����ԭ����ȫ��Ӧ����������Ʒ�����ȩ�백�����ʵ���֮��Ϊ�� ��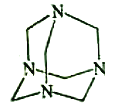
A. 1��1 B. 2��3 C. 3��2 D. 2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧʵ��̽�������Ļ�ԭ�Բ�����ϵ��ʵ�顣
��1�����������Ϻ�ɫͭ˿�Ƽ�Ȧ���ھƾ��ƻ����ϼ��ȣ���ͭ˿��ں��Ƚ�ͭ˿�������ɵ��Ȼ�茶�������̷����а�ɫ�������ɣ��ó�ͭ˿��ͭ˿��ת��Ϊ�������Ϻ�ɫ���ں���ͭ��ʱ���Ȼ�麟�ȥͭ�����������ͭ�������˸�ԭ��������ɸ÷�Ӧ��
![]()
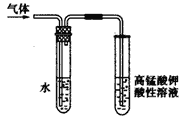
��2����������װ�ã����������������MxOy��Ӧ����M��H2��H2O��ͨ����������ˮ���������ⶨM�����ԭ��������a���Լ���Ũ��ˮ��
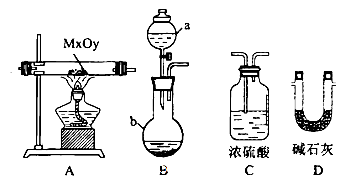
������a������Ϊ__________������b��װ�˵��Լ�������____________.
�ڰ�����������ȷ��װ������˳��Ϊ������ţ�װ�ÿ��ظ�ʹ�ã���___________��
��ʵ�����ʱ��Ӧ����__________������ţ���
I��Ϩ��Aװ�õľƾ���
II��ֹͣ��a�еμ�Һ��
����ʵ����ȷ��ȡ���������������Ϊmg����ȫ��Ӧ�������ˮ������Ϊng����M�����ԭ������Ϊ__________ (�ú�X��y��m��n��ʽ�ӱ�ʾ)��
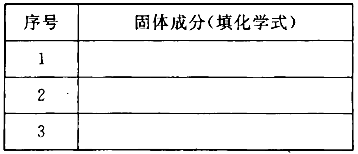
��3��������������MxOyΪFe2O3������Ӧ���������ϡ���ᣬȻ��μ�KSCN��Һû�������Ա仯���Ʋ�ù���ɷֿ����ǣ�����ѧʽ�����±�������Ϊ�м��ֿ�����֣���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com