
【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
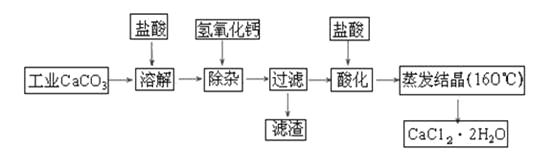
(1)除杂操作时加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:
①___________________________;②___________________________;
(3)测定样品中Cl-含量的方法是:
A.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;B.量取25.00 mL待测溶液于锥形瓶中;C.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.00 mL。
①上述测定过程中不需要用盛装溶液润洗的仪器有 ,若润洗后会导致结果
②计算上述样品中CaCl2·2H2O的质量分数为________________;
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有: ; 。
(4)工业上冶炼金属钙的方法是 ;请写出此冶炼的化学反应方程式________________;
【答案】(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全。
(2)①将溶液中的少量Ca(OH)2转化为CaCl2; ②防止溶液吸收空气中CO2
(3)①锥形瓶;偏高;②98%;③样品中存在少量的NaCl ;少量的CaCl2 ·2H2O失水(4)电解法;CaCl2(熔融)= Ca+Cl2↑
【解析】
试题分析:工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质),加入盐酸可完全溶解生成氯化钙、氯化铁以及氯化钠、氯化铝等,加入氢氧化钙溶液,以除去溶液中少量的Fe3+,然后在酸性条件下蒸发结晶可得到CaCl22H2O,
(1)Fe3+与KSCN反应生成红色物质Fe(SCN)3,检验Fe3+是否存在的,选用KSCN溶液,故答案为:取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3 沉淀完全;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2; ②防止Ca2+在蒸发时水解;③防止溶液吸收空气中CO2,
故答案为:将溶液中的少量Ca(OH)2转化为CaCl2;防止Ca2+在蒸发时水解;防止溶液吸收空气中CO2;
(3)①上述测定过程中锥形瓶不能用盛装溶液润洗,否则会导致结果偏高,故答案为:锥形瓶;偏高;
②样品中n(Cl-)=0.05000molL-1×0.020L×10=0.010mol,根据n(AgCl)=2n(CaCl2·2H2O),则n(CaCl2·2H2O)=0.0050mol,所以m(CaCl2·2H2O)=0.0050mol×147g/mol=0.735g,则有:![]() ×100%=98%,故答案为:98%;
×100%=98%,故答案为:98%;
③样品中存在少量的NaCl会导致CaCl2·2H2O的物质的量增大.同样若CaCl2·2H2O失水导致分母变小,值偏大,故答案为:样品中存在少量的NaCl或少量的CaCl2·2H2O失水。
(4)钙的活泼型比较强,工业上冶炼金属钙,一般采用电解法;冶炼的化学反应方程式为CaCl2(熔融)= Ca+Cl2↑,故答案为:电解法;CaCl2(熔融)= Ca+Cl2↑。


科目:高中化学 来源: 题型:
【题目】明矾性味酸涩,在我们的生活中常用作净水剂。下列关于此物质的说法错误的是
A.光束通过该物质水溶液,能产生丁达尔效应
B.可用于除去水中的重金属离子
C.将其加BaCl2溶液,有沉淀生成
D.其化学式是K2SO4·Al2(SO4)3·24H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体中可能含有Cl2、O2、SO2、NO、N2中的两种或多种。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是
A.肯定有SO2和NOB.肯定没有Cl2、O2和NO
C.可能有Cl2和O2D.肯定只有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列要求,回答问题:
Ⅰ.右图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
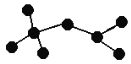
(1)用系统命名法命名 。
(2)M的一氯代物有 种。
(3)M是由某烯烃加成生成的产物,则该烯烃可能有 种结构。
Ⅱ.A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
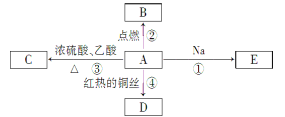
(1)A的名称________;C的分子式为 。
(2)A、C、D有机物中所含官能团名称 。
(3)写出下列反应的化学方程式:
反应①__________________________;
反应③___________________________;
反应④___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。如:CH3-CH=CH-CH3可简写为![]() 某有机物X的键线式为
某有机物X的键线式为![]()
(1)X与足量的H2在一定条件下反应可得到有机物Y,则Y分子的一氯取代产物有_________种。
(2)X属于(填下列选项代码)______________。
A.芳香烃 B.环烃 C.不饱和烃 D.炔烃
(3)X的同分异构体Z属于芳香烃,能使溴水褪色,Z的结构简式为_______________,该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程式_________________。
(4)某醇W与X的相对分子质量相同,1mol W与足量Na反应能产生标准状况下的氢气22.4 L,经测定W分子有如下特点:①一个碳原子最多连接一个官能团;②该分子不存在官能团位置异构现象。则W的结构简式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成纤维Z的吸湿性接近于棉花。合成Z的流程图如下所示: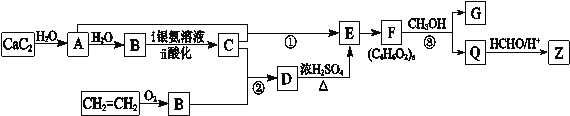
已知:下列反应中R、R′、R″代表烃基
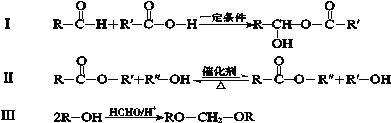
(1)A的结构简式是 。
(2)B的分子式为C2H4O,其官能团的名称是 。
(3)反应①的化学方程式是 。
(4)下列说法正确的是 。(填字母)
a.D→E的反应类型为消去反应 b.D能与Na、NaOH、NaHCO3反应
c.Q分子中含有—OH d.G在酸性或碱性环境中均能水解
(5)E有多种同分异构体,与E具有相同官能团的有 种(含顺反异构体,不包括E),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是 。
(6)合成纤维Z含有六元环状结构,Z的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
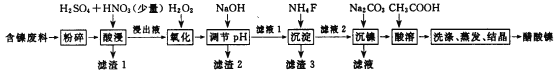
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
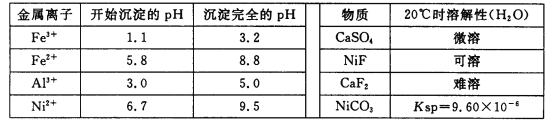
(1)调节pH步骤中,溶液pH的调节范围是____________。
(2)滤渣1和滤渣3主要成分的化学式分别是____________、_____________。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式_____________。
(4)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式_______________。
(5)沉镍过程中,若c(Ni2+)=2.0 mol· L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为______g。(保留小数点后1位有效数字)
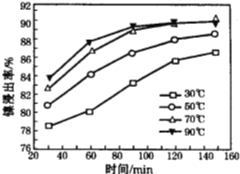
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为________℃、_______min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钦(TiO2)表面作用使海水分解得到氢气的新技术:![]() 。制得的氢气可用于燃料电池。试回答下列问题:
。制得的氢气可用于燃料电池。试回答下列问题:
(1)海水光解产物应用于燃料电池的整个过程中完成了能量的转化:____能转变为____能,最后转化 为_______能。
(2)水分解时,断裂的化学键为_____键(填“共价”或“离子”),分解海水的反应属于____反应(填“放热”或“吸热”)。
(3)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2—4e-=2H2O;B极:O2+4e-=2O2-,则A极是电池的____极;电子从该极____(填“流入”或“流出”)。
(4)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。该原电池的负极材料是_____,正极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中前两周期的六种元素X、Y、Z、M、N、Q原子序数依次增大,六种元素价电子数之和为26,原子半径依Y、Z、M、N、Q、X依次减小。依据信息,回答下列问题:
(1)Q的核外电子排布图为 。
(2)除X外,其余元素的第一电离能由小到大的顺序为 (用元素符号作答)。
(3)固体A是由以上六种元素中的某些元素组成的离子晶体,结构类似于CsCl,组成中含M元素的质量分数为73.7%,A所有原子的最外层都满足稀有气体原子结构,A受热分解可生成两种单质气体。写出A的电子式 ,常温下A与水反应的化学方程式为 。
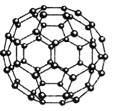
(4)Z元素形成的另一种分子晶体结构如图所示,Z60分子是由60个Z原子构成的,形状酷似足球,有32个面,其中12个面为正五边形,20个面为正六形。Z60分子可与Q元素形成的单质Q2发生加成反应,则加成产物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com