
【题目】明矾性味酸涩,在我们的生活中常用作净水剂。下列关于此物质的说法错误的是
A.光束通过该物质水溶液,能产生丁达尔效应
B.可用于除去水中的重金属离子
C.将其加BaCl2溶液,有沉淀生成
D.其化学式是K2SO4·Al2(SO4)3·24H2O
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于同系物、同分异构体的叙述不正确的是( )
A.同系物之间也可以互为同分异构体
B.同分异构体具有相同的相对分子质量
C.两个同系物之间相对分子质量相差14或14的整数倍
D.同系物具有相似的化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2通至下列溶液中:①次氯酸钙溶液;②澄清石灰水;③氯化钙溶液;④饱和碳酸钠溶液;⑤氨的氯化钠饱和溶液,溶液会出现浑浊的有几种( )
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是以高铁酸盐(K2FeO4)和锌为电极材料,KOH 溶液为电解质溶液。具有能量密度 大、体积小、重量轻、寿命长、无污染等优点。该电池放电时的总反应为:3Zn+2K2FeO4+8H2O=3Zn(OH) 2+2Fe(OH) 3+4KOH。下列说法不正确的是
A.该电池放电过程中电解质溶液碱性增强
B.正极反应式为 2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-
C.电子由 Zn 电极流出,经 KOH 溶液流向正极
D.该电池在放电时,K+定向移动到电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.可燃冰的主要成分是CH4·nH2O
B.一定条件下,煤和氢气作用,可以得到液体燃料
C.往油脂皂化反应后的溶液中加入热的饱和食盐水,搅拌后在烧杯底部析出固体
D.石油催化裂化、裂解都是炼制石油加工的重要手段,均属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,2.24 L苯中含有碳碳双键数为0.3NA
B.0.1molN2和0.3molH2在高温、高压及催化剂下充分反应,产物的分子数为0.2NA
C.0.1molCH4与0.1molCl2混合充分光照,生成CH3Cl分子数为0.1 NA
D.0.1mol甲烷和乙烯组成的混合气体完全燃烧,生成的水分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告指出:建设生态文明是中华民族永续发展的千年大计,必须树立和践行绿水青山就是金山银山的理念……实行最严格的生态环境保护制度,形成绿色发展方式和生活方式。下列有关节约资源和保护环境的说法不正确的是
A.用脱硫处理的煤代替原煤作燃料可以有效减少空气中SO2气体的含量
B.煤经气化和液化两个物理过程,可变为清洁能源,减少对环境的污染。
C.使用地热能、生物质能等非化石能源可减少PM2.5
D.创新生产工艺,实现电动机车替代燃油机车符合绿色发展方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种物质:①乙烷;②乙烯;③乙醇;④苯;⑤聚乙烯。其中既不能使酸性KMnO4溶液褪色,也不能使溴的CCl4溶液褪色的是( )
A.①②③⑤B.③④C.①④⑤D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
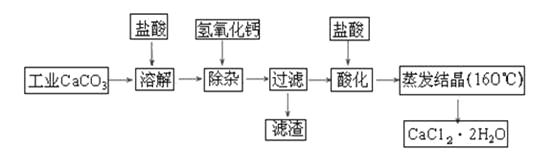
(1)除杂操作时加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:
①___________________________;②___________________________;
(3)测定样品中Cl-含量的方法是:
A.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;B.量取25.00 mL待测溶液于锥形瓶中;C.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.00 mL。
①上述测定过程中不需要用盛装溶液润洗的仪器有 ,若润洗后会导致结果
②计算上述样品中CaCl2·2H2O的质量分数为________________;
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有: ; 。
(4)工业上冶炼金属钙的方法是 ;请写出此冶炼的化学反应方程式________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com