
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示,根据图中数据填空:

(1)该反应的化学方程式为______________________________;
(2)反应开始至2min,以气体Z表示的平均反应速率为__________;
(3)平衡时容器内混合气体密度比起始时________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时_________;
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是_________。
2HI(g)达到平衡状态的是_________。
(2)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。
C(g)+D(g)达到平衡状态的是________。
【答案】3X(g)+ Y(g)![]() 2Z(g) 0.01molL-1min-1 相等 变大 7:5 ⑤ ②④
2Z(g) 0.01molL-1min-1 相等 变大 7:5 ⑤ ②④
【解析】
根据反应物生成物的变化量之比书写相应的反应方程式;根据速率表达式计算反应速率;根据密度公式及摩尔质量公式比较反应前后密度和摩尔质量的变化;运用三段式法进行相关计算;根据化学平衡状态的本质和特征分析反应达到平衡的标志。
(1)根据图示的内容知道,X和Y是反应物,Z为生成物,X、Y、Z的变化量之比是0.3:0.1:0.2=3:1:2,则反应的化学方程式为:3X(g)+ Y(g)![]() 2Z(g);
2Z(g);
(2)反应开始至2min,以气体Z表示的平均反应速率为:υ(Z)=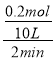 =0.01mol/(L·min);
=0.01mol/(L·min);
(3)混合气体密度![]() ,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变;混合气体的平均相对分子质量
,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变;混合气体的平均相对分子质量![]() ,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,因此,本题正确答案是:相等;变大;
,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,因此,本题正确答案是:相等;变大;
(4) 3X(g)+ Y(g)![]() 2Z(g) (设Y的变化量是x)
2Z(g) (设Y的变化量是x)
初始量 a b 0
变化量 3x x 2x
某时刻量 a-3x b-x 2x
当n(X)=n(Y)=2n(Z)时, a-3x=b-x=4x,则a=7x,b=5x,所以a:b=7:5;
Ⅱ.(1)①反应前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故①错误;②组分都是气体,气体质量不变,是恒容状态,容器的体积不变,因此密度不变,不能说明反应达到平衡,故②错误;③反应前后气体系数之和相等,因此物质的量不变,不能说明反应达到平衡,故③错误;④根据M=m/n,组分都是气体,气体质量不变,气体总物质的量不变,因此当M不变,不能说明反应达到平衡,故④错误;⑤I2是有颜色的气体,因此颜色不变,说明反应达到平衡,故⑤正确;⑥没有指明反应进行方向,故⑥错误;
(2)①反应前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故①错误;②A为固体,其余为组分都是气体,气体质量增加,是恒容状态,容器的体积不变,因此密度不变,说明反应达到平衡,故②正确;③气体物质的量不变,因此总物质的量不变,不能说明反应达到平衡,故③错误;④根据M=m/n,气体质量增加,气体物质的量不变,因此当M不变,说明反应达到平衡,故④正确;⑤题目中没有说明气体的颜色,因此颜色不变,不能说明反应达到平衡,故⑤错误;⑥没有指明反应进行方向,故⑥错误。
故答案为: (1). ⑤;(2)②④。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是( )
A.古文说“冰,水为之,而寒于水”说明等量的水和冰相比,冰的能量更高
B.化学反应遵循质量守恒定律的同时,也遵循能量守恒定律
C.已知C(石量,s)=C(金刚石,s) H>0,则金刚石比石墨稳定
D.任何化学反应都伴随着能量变化,其表现形式只有吸热和放热两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A. 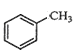 苯环上的一个氢原子被含1个氯原子取代,所得产物有5种
苯环上的一个氢原子被含1个氯原子取代,所得产物有5种
B. 丁烷(C4H10)的二氯取代物只能有4种
C. 菲的结构式为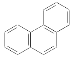 ,其一硝基取代物有10种
,其一硝基取代物有10种
D. 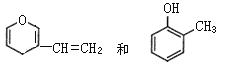 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.1molCO2 的质量为44g/molB.CO2的摩尔质量为44g
C.CO2的摩尔质量等于CO2的相对分子质量D.NA个CO2的质量(以克为单位)与CO2的相对分子质量在数值上相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能说明苯酚是弱酸的实验事实是
A. 苯酚遇FeCl3溶液呈紫色 B. 苯酚能与NaOH溶液反应
C. 常温下苯酚在水中的溶解度不大 D. 将CO2通入苯酚钠溶液出现浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是)
选项 | 已知 | 类推 |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+=== Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=== Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-=== CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=== CaSO3↓+2HClO |
C | 惰性电极电解氯化钠溶液:2Cl-+2H2O | 惰性电极电解MgBr2溶液:2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O | 稀硝酸与Ba(OH)2溶液反应至中性:H++OH-===H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)合成氨工艺(流程如图所示)是人工固氮最重要的途径。

2018年是合成氨工业先驱哈伯(PHaber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) ![]() NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*![]() NH*;NH*+ H*
NH*;NH*+ H*![]() NH2*;NH2* + H*
NH2*;NH2* + H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答:
(1)利于提高合成氨平衡产率的条件有__________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)标准平衡常数KΘ=![]() ,其中pΘ为标准压强(1X105Pa),p NH3、 p N2和p H2为各组分的平衡分压,如p NH3=x NH3 p,p为平衡总压,x NH3为平衡系统中NH3的物质的量分数。
,其中pΘ为标准压强(1X105Pa),p NH3、 p N2和p H2为各组分的平衡分压,如p NH3=x NH3 p,p为平衡总压,x NH3为平衡系统中NH3的物质的量分数。
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则KΘ=_____________(用含w的最简式表示)
②下图中可以示意标准平衡常数KΘ随温度T变化趋势的是_______。
 (3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
(3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由________________________。
②关于合成氨工艺的下列理解,正确的是_______。
A.合成氨反应在不同温度下的△H和△S都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(二)高铁酸钾(K2FeO4)可用作水处理剂。某同学通过“化学-电解法”探究的合成,其原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4。

(1)请写出“化学法”得到FeO42-的离子方程式___________________________。
(2)请写出阳极的电极反应式(含FeO42-)___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN是重要的化工原料,可应用于冶金等领域,回答下列问题:
(1)NaCN中C的化合价为_____;写出NaCN的电子式:_______________;
(2)现代开采金矿的流程如下:
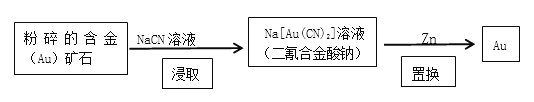
“粉碎”的目的是____________________;“浸取”反应的氧化剂是____________;消耗的锌与生成的金的物质的量之比为___________。
(3)工业上常用纯碱、焦炭、氨气反应制备NaCN,写出反应的化学方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com