
现有铝和过氧化钠的固体混合物样品,加入稀硫酸使混合物完全溶解,所得溶液中 c(Al3+) : c(SO42-) :c(H+) = 1 :4 :2 ,则原固体混合物中铝元素与氧元素的质量比为( )
A. 1:3 B.3:4 C.9:8 D.9:16
科目:高中化学 来源: 题型:
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是 ;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该 结晶水合物的相对分子质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是 。
结晶水合物的相对分子质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是 。
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源: 题型:
研究性学习小组进行SO2的制备及性质探究实验。
⑴ 根据反应Na2SO3(固) + H2SO4(浓) == Na2SO4 + SO2↑+H2O,制备SO2气体。
用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。

② 实验过程中,使用分液漏斗滴加浓硫酸的操作是__________________
__________。
⑵ 将SO2气体分别通入下列溶液中:
① 品红溶液,现象是__________________________________________________。
② 溴水溶液,现象是_________________________________________________。
③ 硫化钠溶液,现象是________________________________________________。
⑶ 有一小组在实验中发现,SO2氧化产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)
① 原因_______________________,验证方法________________________________。
② 原因_______________________,验证方法________________________________。
③ 原因_______________________,验证方法________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将足量的铜屑加入到100 mL浓度均为2 mol·L-1的HNO3和H2SO4的混合溶液中,充分反应后,转移电子的物质的量为 ( )
A.0.6 mol B.0.8 mol C.0.45 mol D.0.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L SO3中所含有分子数为NA
B. 常温下,28 g 乙烯和丙烯的混合物中所含化学键一定为6NA
C. 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定为4NA
D. 1 L 1mol/L NH4NO3溶液中氮原子数目小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H+(aq) + OH-(aq) = H2O (l) ;△H = -57.3 KJ/mol . 则下列热化学方程式正确的是( )
A. CH3COOH(aq) + NaOH(aq) = CH3COONa (aq) + H2O(l); △H=-57.3KJ/mol
B. H2SO4(aq) + Ba(OH)2(aq) = BaSO4 (s) + 2 H2O(l) ; △H= -114.6KJ/mol
C. HCl(aq) + NaOH(s) = NaCl (aq) +H2O(l) ; △H= -57.3KJ/mol
D. HI(aq) + KOH(aq) = KI(aq) + H2O(l) ;△H= -57.3KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
利用化学原理可以对工厂排放的废水、废渣等进行有效检测。某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+,其次是Fe3+, Fe2+, Al3+, Ca2+, Mg2+)

常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | — |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
(1) 酸浸时,为了提高浸取率可采取的措施是 (至少一条)
(2) 调pH=4.0是为了除去 (填Fe3+, Al3+, Ca2+, Mg2+)
(3) 钠离子交换树脂的原理为Mn+ + n NaR → MRn +nNa+,
被交换的杂质离子是 (填Fe3+, Al3+, Ca2+, Mg2+)
(4) 试配平下列氧化还原反应方程式:
Na2Cr2O7 + SO2 + H2O = Cr(OH)(H2O)5SO4 + Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
用下面的方案进行某些离子的检验,其中方案设计最严密的是
A.检验试液中的SO :试液
:试液 无沉淀
无沉淀 白色沉淀
白色沉淀
B.检验试液中的SO :试液
:试液 无沉淀
无沉淀 白色沉淀
白色沉淀
C.检验试液中的I-:试液 深黄色溶液
深黄色溶液 深黄色溶液
深黄色溶液
D.检验试液中的CO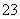 :试液
:试液 白色沉淀
白色沉淀 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)>c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com